近期���,我院康復醫(yī)學科倪國新教授團隊在《Journal of Advanced Research》期刊上發(fā)表題目為:“Antioxidant taurine inhibits chondrocyte ferroptosis through upregulation of OGT/Gpx4 signaling in osteoarthritis induced by anterior cruciate ligament transection”的文章�。該文章探究了?��;撬嵬ㄟ^激活OGT/Gpx4 信號抑制軟骨細胞鐵死亡���,從而緩解OA小鼠軟骨退變的作用機制,為運動損傷繼發(fā)OA的預防和治療提供了新的方向����。文章的通訊作者是廈門大學附屬第一醫(yī)院康復醫(yī)學科倪國新教授和廈門大學化學化工學院林東海教授;第一作者是倪國新教授課題組博士生周緒昌��,聯(lián)合培養(yǎng)研究生楊雅靜�,鄧輝麗以及林東海教授課題組博士生邱旭�。

研究背景
骨關節(jié)炎(Osteoarthritis, OA)是一種慢性退行性關節(jié)疾病�����。與其他類型的OA不同�,繼發(fā)于運動損傷的OA有明確的損傷事件。這種明確的 “起始點”事件為運動損傷繼發(fā)OA的針對性預防和治療提供了可能�����。深入探究運動損傷繼發(fā)OA的潛在機制對科學有效地預防繼發(fā)性OA是至關重要的�����。代謝組學作為生命科學研究領域的新興研究手段���,通過高通量檢測和分析細胞代謝的小分子底物����、中間產(chǎn)物和終產(chǎn)物����,可即時反映和了解細胞生理和病理的動態(tài)變化�����,從而從代謝角度解釋疾病發(fā)生和發(fā)展過程中的內(nèi)在機制。在本研究中��,我們通過使用前交叉韌帶橫斷術(ACL transection, ACLT)構建運動損傷繼發(fā)OA的大鼠動物模型�����。提取ACLT術后不同周齡(0w�����,4w�����,8w和12w)大鼠的原代軟骨細胞進行代謝組學分析���。結果發(fā)現(xiàn)?����;撬峥赡苁菍е逻\動損傷繼發(fā)OA進展的關鍵代謝分子���。隨后���,使用牛磺酸處理炎性軟骨細胞后進行轉錄組學和代謝組學發(fā)現(xiàn)�,O-GlcNAc轉移酶(OGT)依賴的O-GlcNAcylation和Gpx4依賴的鐵死亡可能是介導牛磺酸對軟骨細胞的炎癥保護作用的潛在機制���。這一研究假設通過功能驗證得到證實����。隨后����,進一步的實驗表明,Gpx4 與 OGT 蛋白可能存在直接結合位點�����,這為 Gpx4 蛋白可能存在 O-GlcNAc糖基化修飾提供了證據(jù)��。最后�����,我們通過動物實驗證明了OGT依賴的O-GlcNAcylation和Gpx4依賴的鐵死亡可能是?��;撬岜WoACL損傷小鼠軟骨退化的潛在機制��。綜上所述�����,本研究闡明了?�;撬崮軌蛲ㄟ^激活OGT/Gpx4 信號抑制軟骨細胞鐵死亡���,從而緩解OA小鼠軟骨退變。該研究為運動損傷繼發(fā)OA的預防和治療提供了新的方向�����。
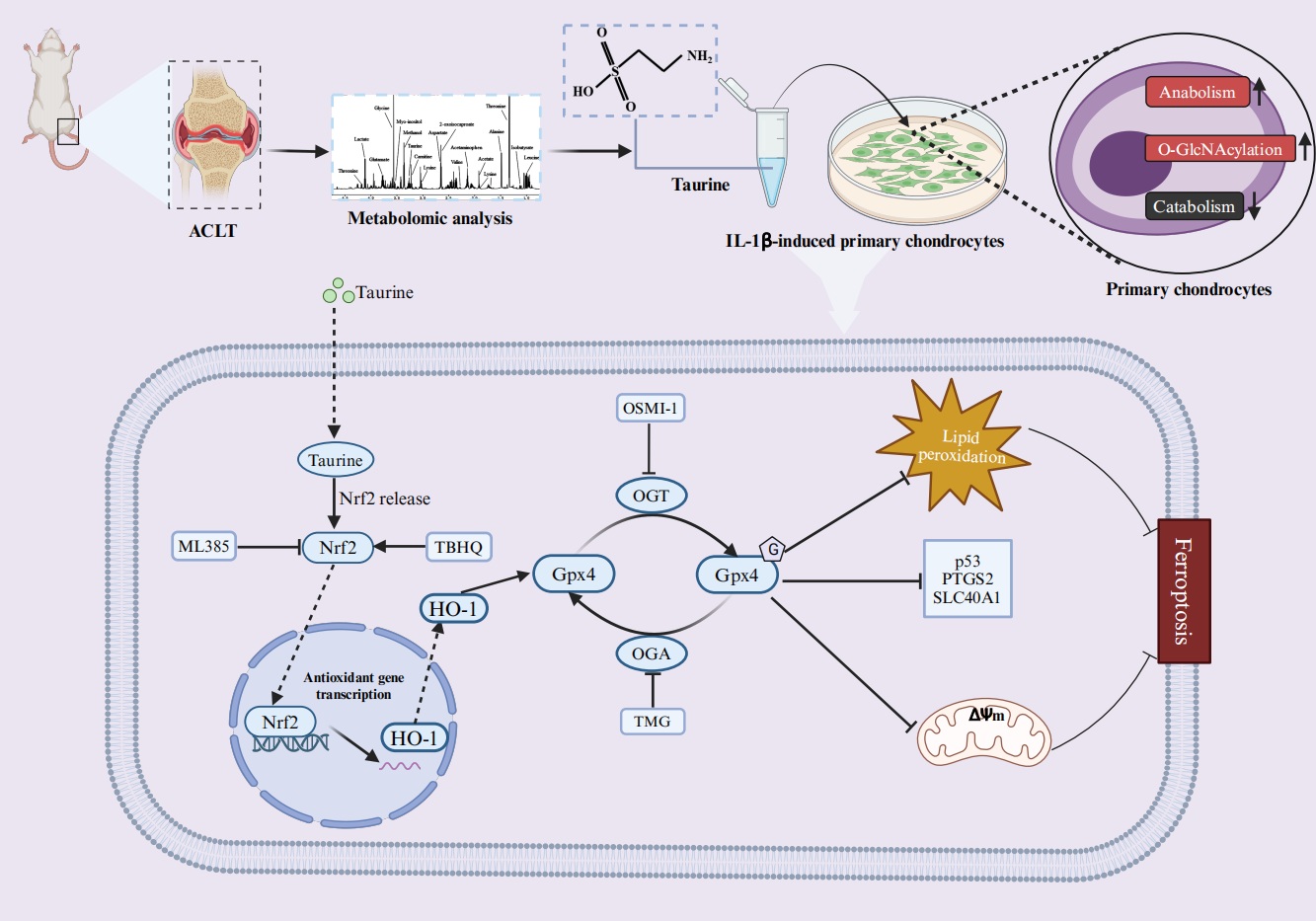
本研究分子機制示意圖
研究結果
1.?;撬峥赡苁沁\動損傷繼發(fā)OA的特征性代謝產(chǎn)物
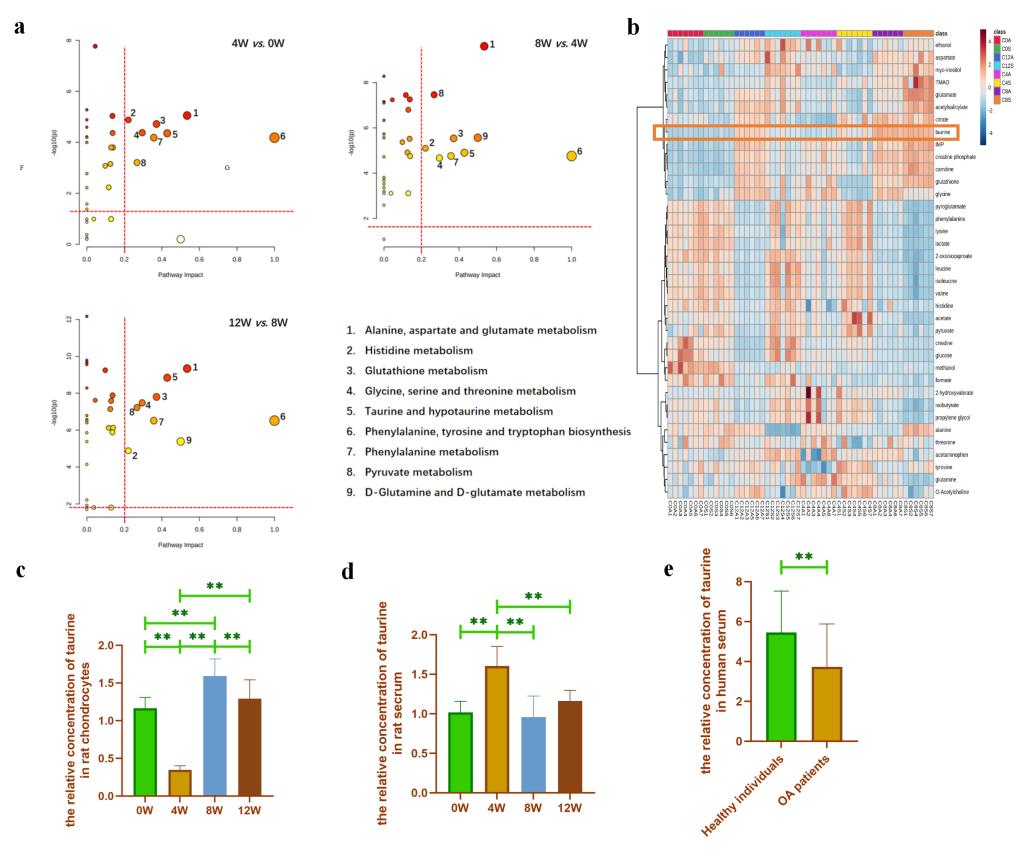
通過ACLT構建大鼠運動損傷繼發(fā)OA動物模型。術后0w����,4w,8w�����,12w,16w和20w取材使用HE染色和番紅O固綠染色檢測發(fā)現(xiàn)隨著ACLT術后周齡的增加�,大鼠軟骨損傷逐漸加重(如圖1a-e所示)。隨后��,我們提取ACLT術后0w�,4w,8w和12w大鼠原代軟骨細胞進行代謝組學檢測(16w和20w大鼠由于周齡較大�,細胞活性較差,無法擴增足夠的細胞進行代謝組學檢測)���。發(fā)現(xiàn)?���;撬峥赡苁?/span>ACLT術后軟骨退變過程中的特征性代謝小分子(如圖2a-c所示)��。此外����,我們還檢測了ACLT術后不同周齡大鼠血液中的牛磺酸含量以及OA患者VS非OA患者血液中的?�;撬岷堪l(fā)現(xiàn)均存在差異表達�。因此�����,我們猜測?;撬峥赡茉?/span>OA的發(fā)生發(fā)展中發(fā)揮重要作用����。
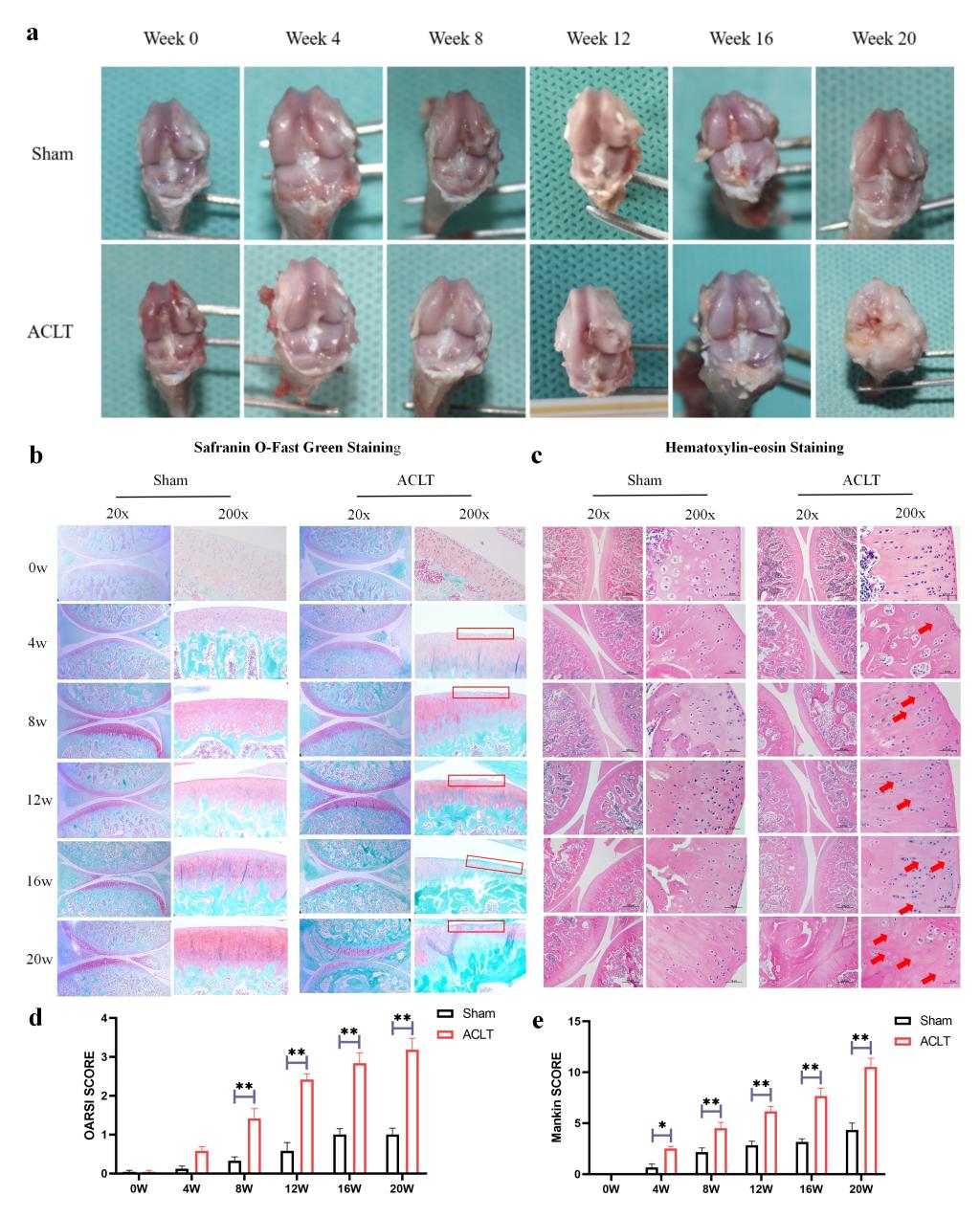
圖1. 前交叉韌帶撕裂術后不同時間點大鼠膝關節(jié)軟骨改變���。(a: 大鼠膝關節(jié)的大體觀察���;b: 大鼠膝關節(jié)的番紅O固綠染色;c: 大鼠膝關節(jié)的HE染色�����;d:大鼠膝關節(jié)的OARSI評分���;e:大鼠膝關節(jié)的Mankin評分����。)
圖2. 前交叉韌帶撕裂術后不同時間點大鼠軟骨細胞的代謝組學分析��。(a: 軟骨細胞代謝物的代謝途徑分析;b:軟骨細胞代謝物濃度熱圖����;c:通過代謝組學分析ACLT組與Sham組軟骨細胞牛磺酸濃度的相對比值�;d:通過代謝組學分析ACLT組與Sham組之間血清牛磺酸濃度的相對比值�����;e:通過代謝組學分析OA患者與非OA患者血清?;撬釢舛鹊南鄬Ρ戎?/span>。)
2.?;撬峋徑?/span>IL-1β誘導的軟骨細胞炎性損傷
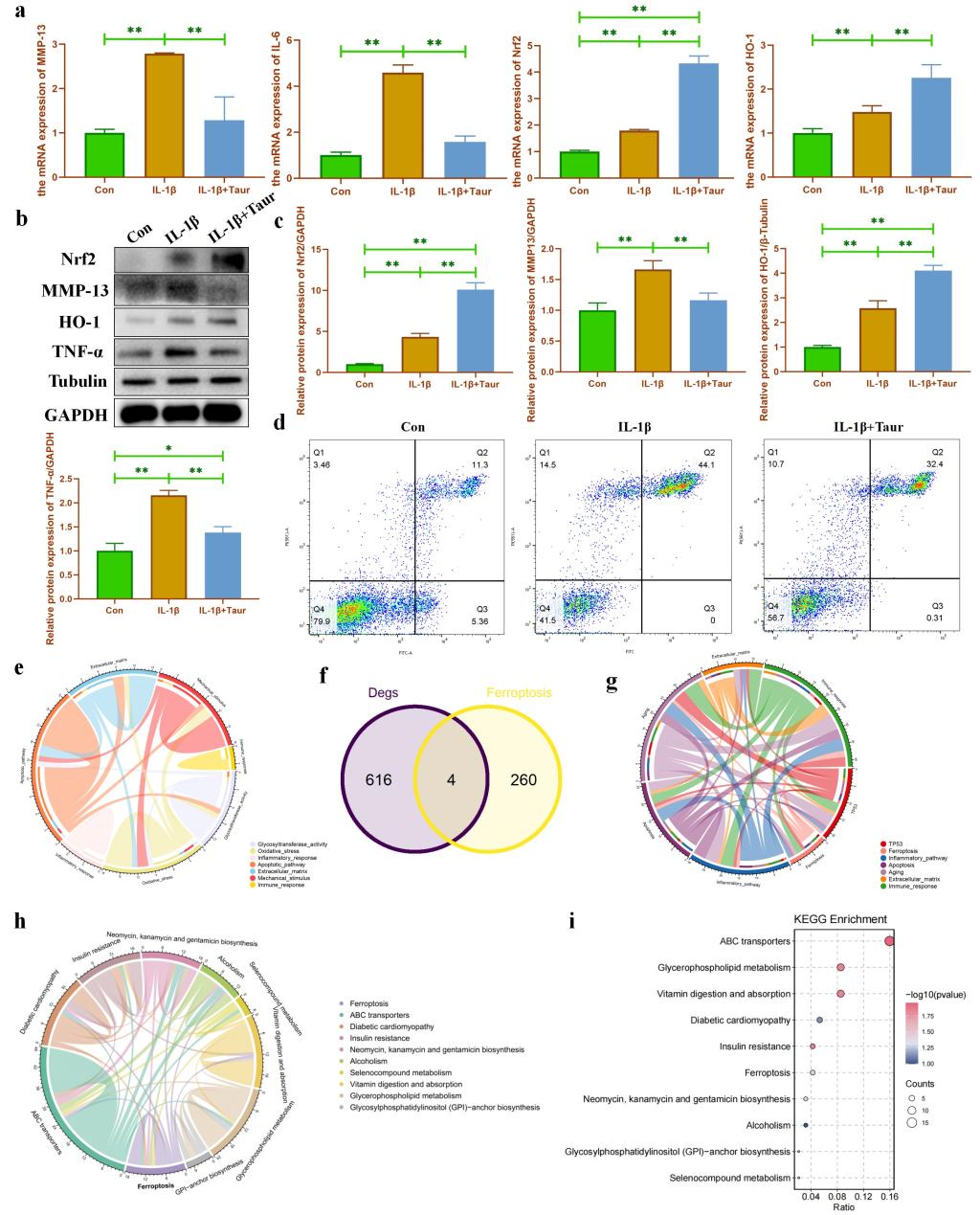
由于牛磺酸在OA軟骨退變過程中呈現(xiàn)差異表達�����,我們猜測補充?���;撬峥赡苁菧p輕軟骨損傷的一種潛在策略。我們首先使用IL-1β處理原代小鼠軟骨細胞來構建OA體外細胞模型���。我們發(fā)現(xiàn)?�;撬崽幚砟軌蛲ㄟ^重塑軟骨細胞代謝來緩解IL-1β誘導的炎性損傷(圖3a-c)�����。此外��,我們還發(fā)現(xiàn)?��;撬崽幚砟軌虿糠帜孓DIL-1β誘導的細胞凋亡(圖3d)。隨后��,我們使用轉錄組學發(fā)現(xiàn)糖基化修飾和鐵死亡可能是?����;撬岜Wo軟骨細胞炎性損傷的潛在機制(圖3e-f)�����。?�;撬岚械鞍最A測的信號通路富集分析也發(fā)現(xiàn)?����;撬峥赡芫哂屑毎F死亡保護作用(圖3g)。最后�����,我們使用代謝組學進一步確定了鐵死亡和糖代謝可能是?�;撬岜Wo軟骨細胞炎性損傷的潛在機制(圖3h-i)�����。結合文獻檢索���,我們提出初步的研究假設����,鐵死亡和O-GlcNAc糖基化修飾可能是?��;撬岜Wo軟骨細胞炎性損傷的潛在調(diào)控機制�����。
圖3. ?;撬?/span>緩解IL-1β誘導的軟骨細胞炎性損傷���。(a:使用qPCR檢測?����;撬釋?/span>炎性軟骨細胞代謝和炎癥相關基因的影響����;b-c:使用WB檢測牛磺酸對炎性軟骨細胞代謝和炎癥相關蛋白的影響���;d:使用流式細胞分析檢測?����;撬釋?/span>IL-1β誘導的軟骨細胞凋亡的影響;e:通過轉錄組學對?;撬崽幚斫M和非處理組之間差異表達基因的信號通路富集分析; f:轉錄組學檢測到的差異基因與鐵死亡基因集的交集����;g:通過生物信息學分析對牛磺酸靶蛋白進行信號通路富集���;h-i:通過代謝組學分析?��;撬崽幚斫M和非處理組之間差異表達代謝物進行信號通路富集����。)
3.?;撬嵬ㄟ^抑制Gpx4依賴的鐵死亡減輕軟骨細胞炎癥損傷
為了驗證Gpx4依賴的鐵死亡參與介導牛磺酸對軟骨細胞炎性損傷的保護作用����。我們首先使用WB檢測發(fā)現(xiàn)牛磺酸能夠部分逆轉IL-1β誘導的軟骨細胞鐵死亡相關蛋白的表達(圖4a)����。隨后,我們使用透射電鏡發(fā)現(xiàn)?��;撬崮軌蚋纳?/span>IL-1β誘導的線粒體嵴和線粒體膜損傷(圖4b)�。進一步使用JC-1檢測發(fā)現(xiàn)?;撬崮軌蚧謴途€粒體膜電位(圖4c-d)。脂質過氧化累積是細胞鐵死亡的重要特征之一��。我們的研究發(fā)現(xiàn)?;撬崮軌蝻@著抑制軟骨細胞中脂質過氧化的累積(圖4e-f)。此外�����,我們使用亞鐵離子檢測試劑盒發(fā)現(xiàn)牛磺酸可以有效降低軟骨細胞內(nèi)亞鐵離子濃度����,從而緩解軟骨細胞鐵死亡(圖4g)。由于Gpx4是鐵死亡的關鍵蛋白���。我們分別使用Gpx4的小分子抑制劑FIN56和shRNA來抑制Gpx4的表達�,結果發(fā)現(xiàn)抑制Gpx4表達能夠部分逆轉?�;撬釋ρ仔攒浌羌毎谋Wo作用(圖4h-j)�。
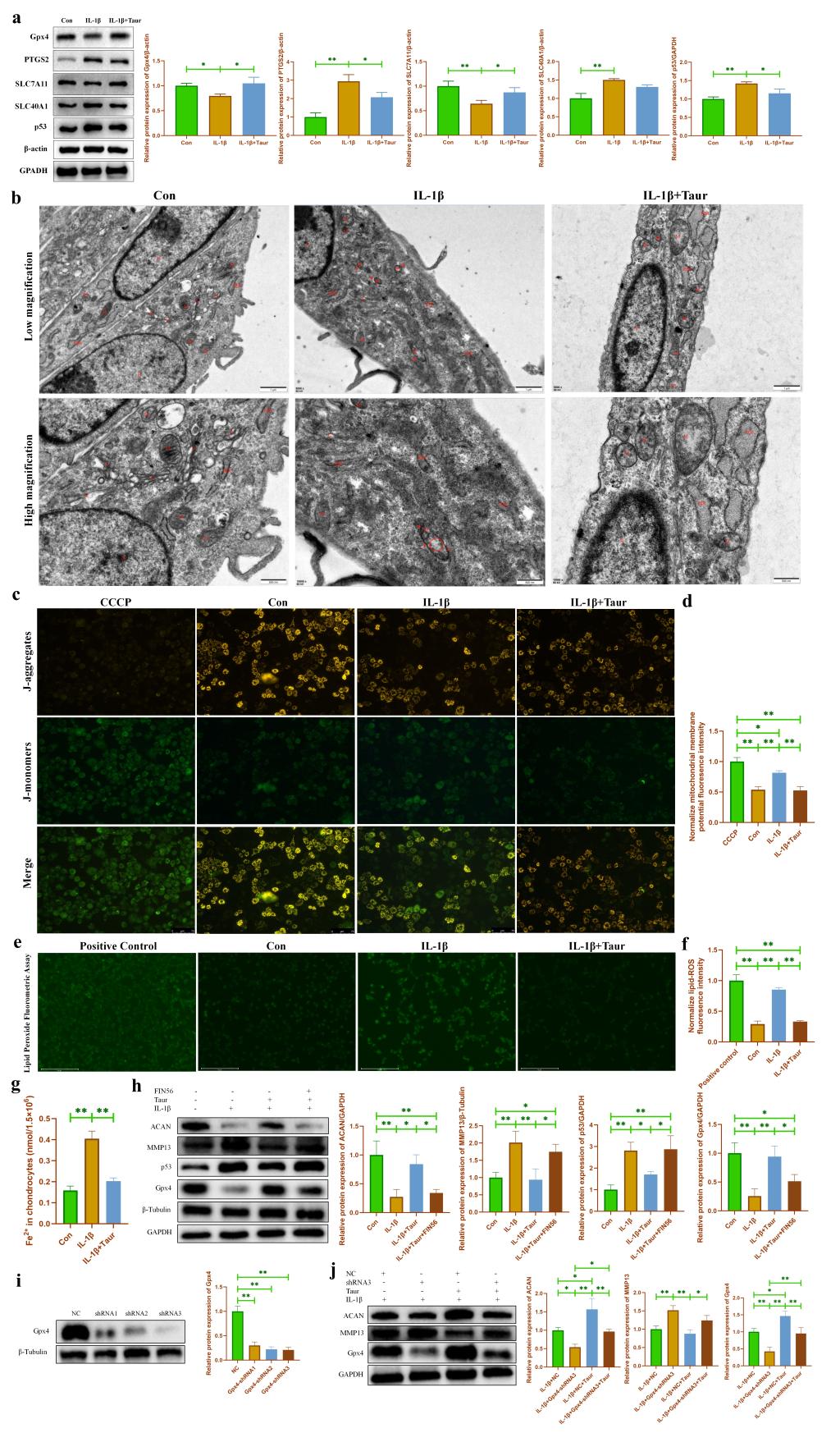
圖4. 牛磺酸通過抑制 Gpx4 依賴的鐵死亡保護軟骨細胞炎性損傷���。(a:通過 WB 檢測牛磺酸處理后炎性軟骨細胞中鐵死亡相關蛋白表達的改變�����;b:通過透射電子顯微鏡檢測?����;撬崽幚砗?/span>炎性軟骨細胞中細胞器的改變;c-d:通過JC-1檢測?����;撬崽幚砗?炎性軟骨細胞中線粒體膜電位的改變�����;e-f:用過氧化脂質檢測試劑盒檢測?;撬崽幚砗?炎性軟骨細胞中脂質過氧化物的變化;g:用亞鐵離子比色測定試劑盒檢測?;撬崽幚砗?/span>炎性軟骨細胞中亞鐵離子濃度的變化;h:通過WB檢測Gpx4抑制劑FIN56處理后軟骨細胞代謝相關蛋白表達的改變�;i-j:通過WB檢測基因敲低Gpx4對軟骨細胞代謝相關蛋白表達的影響。)
4.?����;撬嵬ㄟ^促進OGT依賴性O-GlcNAcylation緩解軟骨細胞炎性損傷
為了驗證OGT依賴性O-GlcNAcylation介導?;撬釋ρ仔攒浌羌毎谋Wo作用。我們首先檢測了輕度損傷OA患者軟骨組織和重度損傷OA患者軟骨組織中O-GlcNAc總蛋白和OGT蛋白的表達��。結果發(fā)現(xiàn)重度損傷OA患者軟骨組織中O-GlcNAc總蛋白和OGT蛋白的表達顯著下降(圖5a)�����。隨后,我們發(fā)現(xiàn)在原代小鼠軟骨細胞中����,O-GlcNAc總蛋白,OGT蛋白以及Gpx4蛋白的表達均隨著IL-1β處理濃度的增加逐漸下降(圖5b)�。此外,我們分別使用小分子藥物OSMI和TMG來抑制/促進軟骨細胞中的O-GlcNAc水平�����,結果發(fā)現(xiàn)抑制O-GlcNAc能夠促進軟骨細胞分解代謝并促進軟骨細胞合成代謝�,而促進O-GlcNAc表現(xiàn)出相反的效果(圖5c)。表明O-GlcNAcylation可能參與軟骨細胞代謝活動的調(diào)控�。進一步的,我們在?����;撬崽幚淼幕A上��,分別使用OSMI和TMG來調(diào)節(jié)軟骨細胞中O-GlcNAc水平�����。我們發(fā)現(xiàn)OSMI處理部分逆轉了?���;撬釋浌羌毎谋Wo作用,而TMG處理進一步增強了?�;撬釋浌羌毎F死亡的保護作用(圖5d)�。JC-1(圖5e),脂質過氧化檢測(圖5f)和細胞亞鐵離子檢測(圖5g)也進一步表明O-GlcNAcylation參與介導了?;撬釋浌羌毎F死亡的保護作用。由于O-GlcNAcylation受到O-GlcNAc糖基轉移酶OGT的調(diào)控�����。因此���,我們分別對OGT進行了敲低和過表達�。結果發(fā)現(xiàn)與OSMI和TMG的效果一致���,敲低OGT能夠抑制軟骨細胞中O-GlcNAcylation���,從而部分逆轉牛磺酸對炎性軟骨細胞的保護作用(圖6a)�����,而過表達OGT則促進了軟骨細胞中O-GlcNAcylation,并進一步增強了?;撬釋ρ仔攒浌羌毎谋Wo作用(圖6b)。
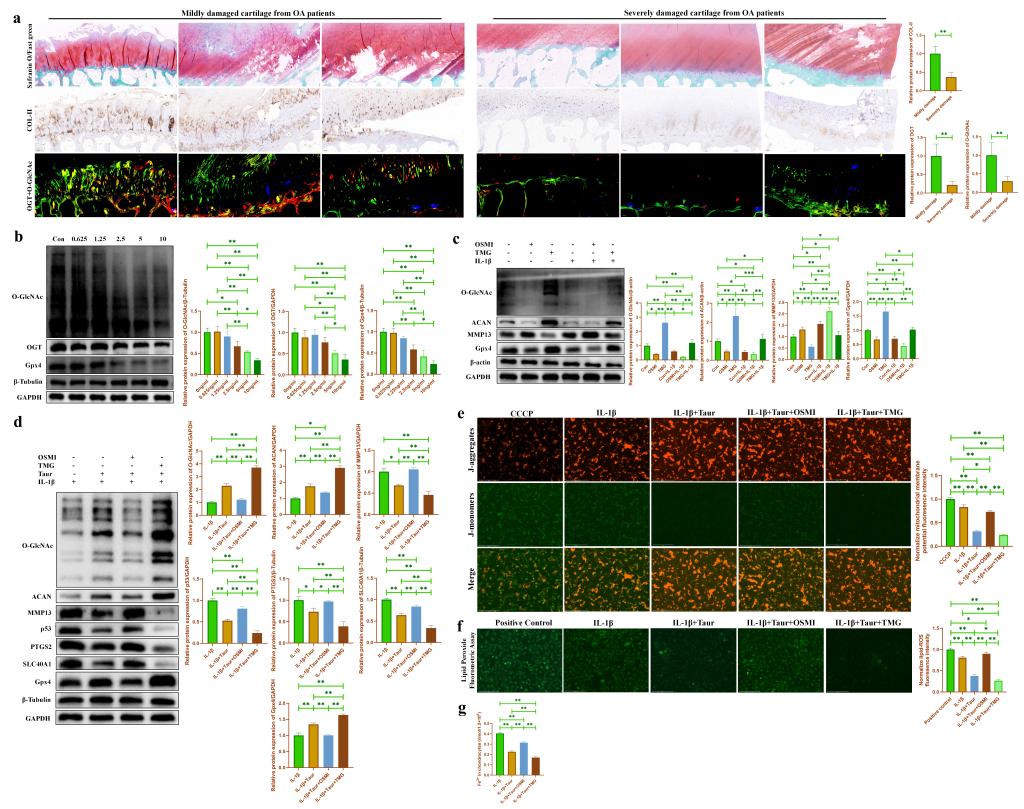
圖5. ?��;撬嵬ㄟ^促進O-GlcNAcylation緩解軟骨細胞炎性損傷��。(a:輕度/重度損傷OA患者軟骨組織的番紅O固綠染色以及COL-II��,O-GlcNAc(紅色標記)和OGT(綠色標記)蛋白的免疫染色��;b:通過WB檢測不同濃度IL-1β處理后軟骨細胞中O-GlcNAc 和OGT蛋白表達的改變���;c:通過WB檢測OSMI/TMG處理后的炎性軟骨細胞中O-GlcNAc以及代謝相關蛋白表達的改變;d:通過WB檢測在?����;撬崽幚砗?��,OSMI/TMG對炎性軟骨細胞中O-GlcNAc以及代謝相關蛋白表達的影響�;e:通過JC-1檢測在?;撬崽幚砗?�,OSMI/TMG對炎性軟骨細胞中線粒體膜電位的影響;f:通過脂質過氧化物檢測試劑盒檢測在?��;撬崽幚砗?�,OSMI/TMG對炎性軟骨細胞中脂質過氧化物的影響����;g:通過亞鐵離子比色檢測試劑盒檢測在?;撬崽幚砗螅?/span>OSMI/TMG對炎性軟骨細胞中亞鐵離子濃度的影響�。)
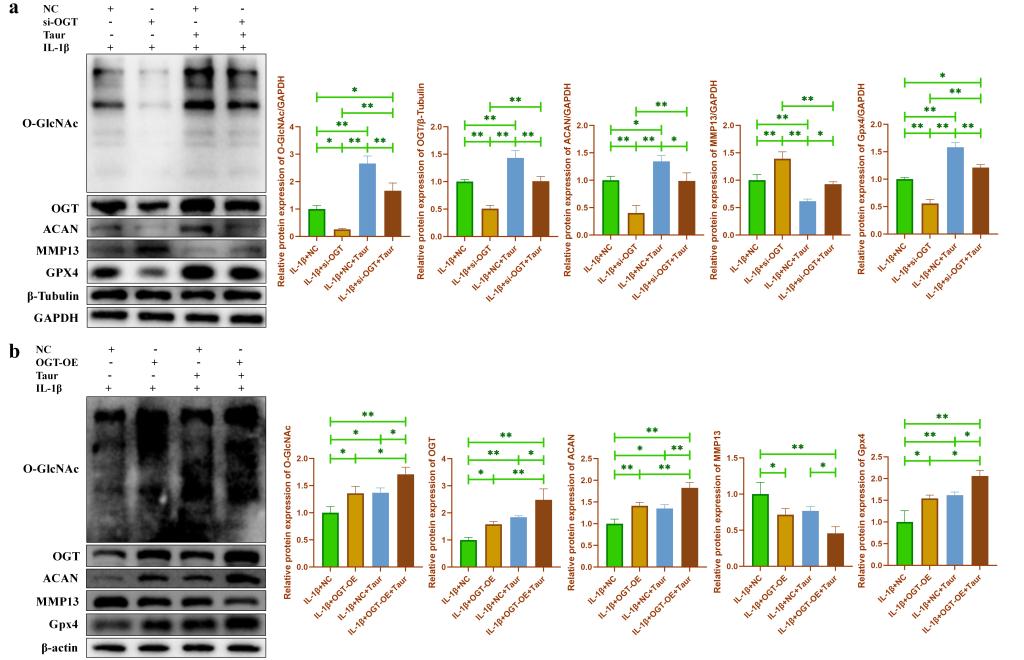
圖6. OGT依賴的O-GlcNAcylation介導牛磺酸對炎性軟骨細胞的保護作用��。(a: 使用WB檢測在?��;撬崽幚砗?�,敲低OGT對炎性軟骨細胞代謝相關蛋白和Gpx4蛋白表達的影響����;b:使用WB檢測在?;撬崽幚砗?��,過表達OGT對炎性軟骨細胞代謝相關蛋白和Gpx4蛋白表達的影響。)
5.OGT促進Gpx4蛋白穩(wěn)定性
由于O-GlcNAcylation是一種普遍存在的蛋白質翻譯后修飾���,我們猜測鐵死亡的關鍵蛋白Gpx4可能具有O-GlcNAc修飾位點���。我們首先使用CHX來阻斷軟骨細胞的蛋白質合成。我們發(fā)現(xiàn)�,隨著CHX處理時間的延長,Gpx4蛋白表達逐漸減少(圖7a)���。OSMI加速了Gpx4的降解(圖7a)�����,而TMG則抑制了Gpx4的降解(圖7b)����。與之一致的是����,敲低OGT的表達會加速Gpx4的蛋白降解(圖7c),而過表達OGT則會抑制Gpx4的蛋白降解(圖7d)�����。此外,MG132處理進一步證明了O-GlcNAcylation可以促進Gpx4的蛋白穩(wěn)定性(圖7e-g)��,其潛在機制可能與抑制泛素化降解有關(圖7h)���。隨后,我們通過免疫沉淀初步驗證了Gpx4蛋白可能存在O-GlcNAcylation(圖7i)����。最后,免疫共沉淀(圖7j-k)和免疫熒光(圖7l)結果驗證了OGT和Gpx4蛋白之間可能存在相互作用�����。上述結果表明���,OGT依賴的O-GlcNAcylation可能通過抑制泛素化降解來穩(wěn)定Gpx4的蛋白表達����。
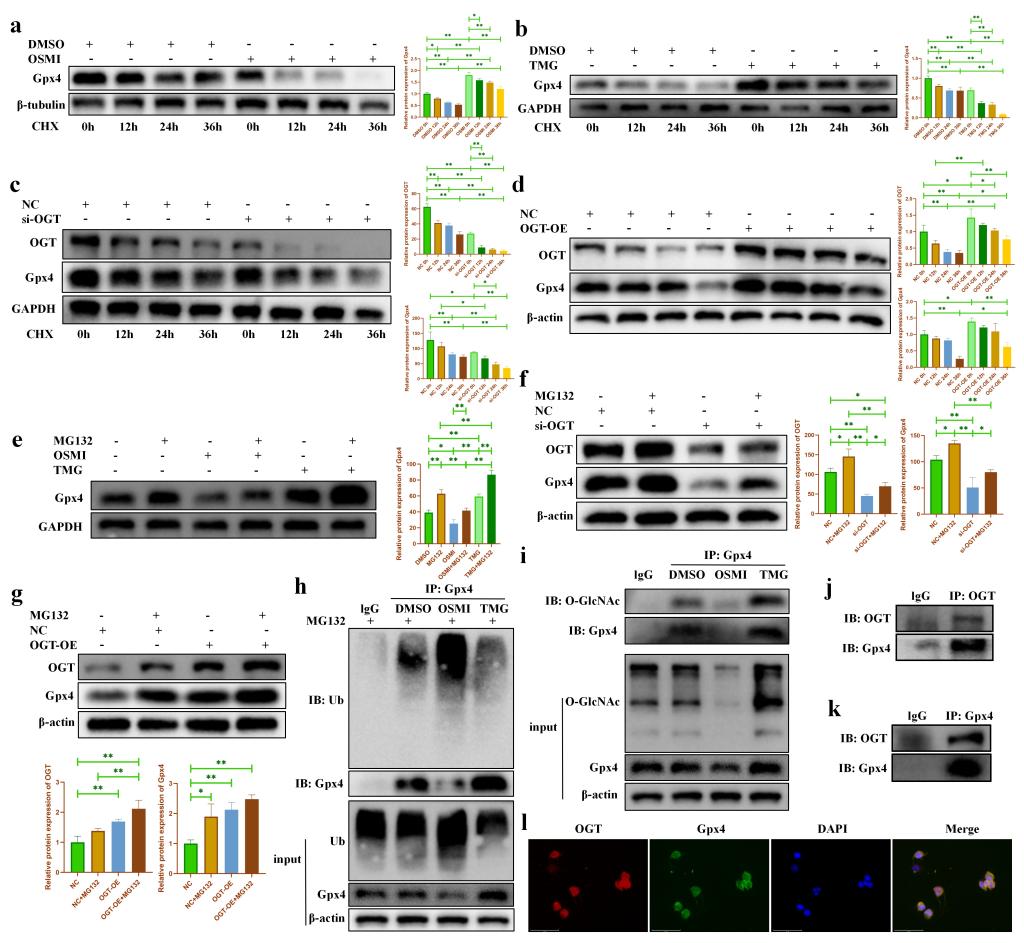
圖7. OGT促進Gpx4的蛋白穩(wěn)定性��。(a-b:不同時間點 CHX(1μM)處理后�����,OSMI/TMG對Gpx4 蛋白降解的影響;c-d:不同時間點 CHX(1μM)處理后�,敲低/過表達 OGT對Gpx4蛋白降解的影響;e:在MG132存在或不存在的情況下�����,OSMI/TMG對Gpx4蛋白降解的影響��;f-g:在MG132存在或不存在的情況下����,OGT 的敲低/過表達對Gpx4蛋白降解的影響;h:免疫沉淀實驗表明Gpx4蛋白可能存在 O-GlcNAcylation�;i-k:免疫共沉淀實驗證明Gpx4蛋白與OGT蛋白之間可能存在相互作用;l:免疫熒光實驗證明Gpx4蛋白與OGT蛋白之間可能存在相互作用����。)
6.牛磺酸通過調(diào)控O-GlcNAcylation和鐵死亡來緩解ACLT誘導的小鼠軟骨退變
最后���,我們通過動物實驗驗證O-GlcNAcylation和鐵死亡參與介導了?�;撬釋浌峭俗兊谋Wo作用�����。在這部分研究中�,我們使用AAV-shRNA-Gpx4進行關節(jié)腔注射來抑制軟骨中Gpx4蛋白的表達。此外�����,分別使用OSMI和TMG關節(jié)腔注射來抑制/促進軟骨組織中的O-GlcNAcylation水平�。所有小鼠均在ACLT術后八周后處死����。HE和番紅O固綠染色顯示牛磺酸能夠有效保護ACLT誘導的小鼠軟骨退變(圖8a-d)�。COL-II是軟骨基質中主要的膠原蛋白成分。我們發(fā)現(xiàn)?��;撬崮軌蛴行Ь徑?/span>COL-II蛋白丟失���。AAV-shRNA-Gpx4和OSMI關節(jié)腔注射均能夠部分逆轉牛磺酸的這一保護作用�,而TMG處理并沒有加重OA小鼠的軟骨退變(圖8e-f)。此外�����,我們還檢測了軟骨組織中O-GlcNAc總蛋白和OGT蛋白的表達。我們發(fā)現(xiàn)?��;撬崮軌蝻@著促進OA小鼠軟骨組織中O-GlcNAc總蛋白和OGT的蛋白表達(圖9a-b)�。上述結果證明�,O-GlcNAcylation和鐵死亡參與介導了牛磺酸對ACLT小鼠軟骨退變的保護作用���。
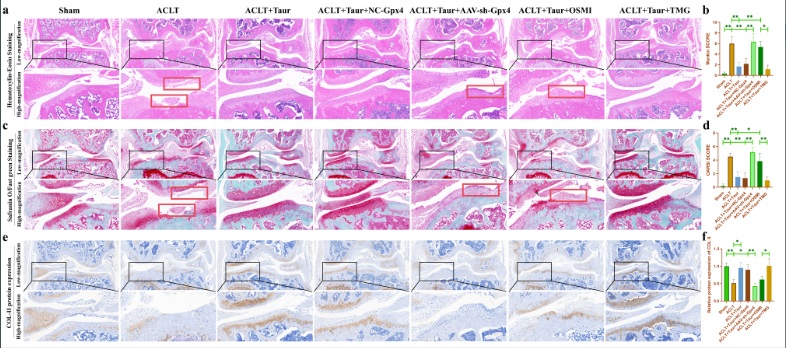
圖8. ?�;撬峋徑?/span>ACLT小鼠的軟骨退變���。(a:小鼠膝關節(jié)的HE染色;b:小鼠膝關節(jié)的Mankin評分����;c:小鼠膝關節(jié)的番紅O固綠染色;d:小鼠膝關節(jié)的OARSI評分�����;e-f:通過免疫組化染色檢測小鼠膝關節(jié)軟骨中COL-II蛋白表達的改變。)
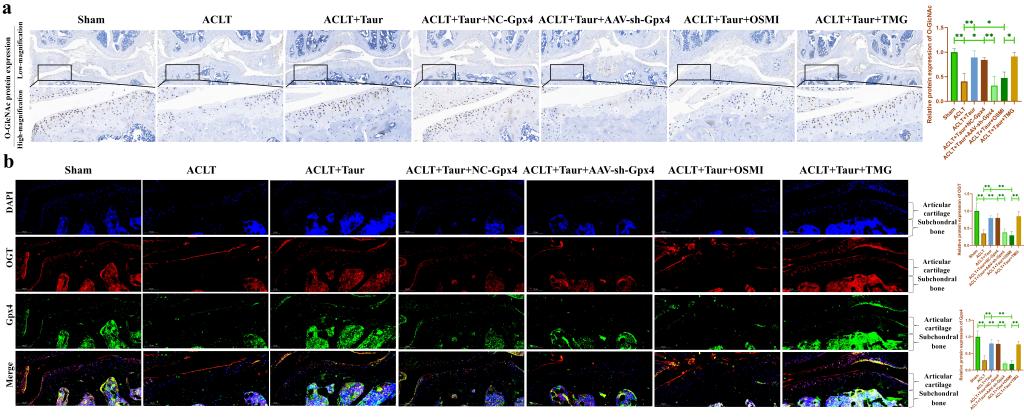
圖9. O-GlcNAcylation和Gpx4參與介導?���;撬峋徑?/span>ACLT小鼠軟骨退變。(a:通過免疫組化染色檢測小鼠膝關節(jié)軟骨中O-GlcNAc總蛋白表達的改變���;b:通過免疫熒光染色檢測小鼠膝關節(jié)軟骨中OGT和Gpx4蛋白表達����。)
研究結論
該研究通過對ACLT誘導的OA大鼠膝關節(jié)軟骨細胞和血清進行代謝組學分析�,確定了運動損傷繼發(fā)OA病變中的特征性代謝分子牛磺酸����。外源性添加?;撬?/span>能夠顯著緩解IL-1β誘導的軟骨細胞炎癥和氧化應激表型。生信分析結合多組學研究揭示��,?����;撬?/span>可能通過抑制Gpx4依賴的鐵死亡和激活OGT依賴的O-GlcNAcylation來緩解IL-1β誘導的軟骨細胞炎性損傷����,并通過動物實驗得到了進一步驗證���。由于牛磺酸是一種非常安全的氨基酸��,常用于食品或藥品添加劑��,該研究結果有望為?���;撬嵩?/span>運動損傷繼發(fā)OA治療中的轉化研究和應用提供科學依據(jù)。
盡管該研究發(fā)現(xiàn)Gpx4依賴性鐵死亡和OGT依賴的O-GlcNAcylation是?��;撬岜Wo軟骨細胞炎性損傷/軟骨退變的潛在機制���。然而,免疫熒光��、免疫沉淀和分子對接等技術并不能充分證明Gpx4和OGT之間可能存在直接相互作用�。未來的研究可以采用更先進的技術,如聯(lián)合免疫沉淀和高分辨率質譜分析����,以明確明Gpx4和OGT之間是否存在直接的物理相互作用��,亦或者是否通過中間分子和信號級聯(lián)進行間接調(diào)控����。此外�����,還需要更多的證據(jù)�,包括表面等離子體共振和細胞熱轉移試驗,以充分證明Gpx4與OGT蛋白之間存在直接相互作用����。未來的研究還可以結合質譜和定突變技術來探索和驗證Gpx4可能存在的O-GlcNAcylation位點。并結合定點突變技術構建 Gpx4基因敲除小鼠�,以全面驗證Gpx4在OA軟骨退變中的功能。此外�,雖然本研究側重于牛磺酸對Gpx4和鐵死亡的下游影響����,但對OA中調(diào)節(jié)鐵死亡的上游調(diào)節(jié)因子的探討并不全面�。未來的研究可以篩選出可能直接或間接影響 Gpx4表達和鐵死亡激活的潛在上游激酶或轉錄因子。值得一提的是�,盡管我們發(fā)現(xiàn) O-GlcNAcylation 水平在 OA 軟骨細胞中降低�,但O-GlcNAcylation水平在OA增生滑膜組織中似乎是升高的(數(shù)據(jù)未展示)���。O-GlcNAcylation在OA滑膜炎性組織中的調(diào)控作用有待進一步探討�,這是非常具有吸引力的研究方向�。
原文鏈接:https://authors.elsevier.com/sd/article/S2090-1232(25)00029-3
倪國新教授:香港大學醫(yī)學院博士,主任醫(yī)師�����,教授��,博士生導師���,德國洪堡學者?����,F(xiàn)任廈門大學附屬第一醫(yī)院康復醫(yī)學科主任����。兼任中華預防醫(yī)學會體育運動與健康分會副主任委員����、中國老年醫(yī)學會運動健康分會副會長����、廈門市康復醫(yī)師分會會長���、廈門市體衛(wèi)融合專家指導委員會主任委員等職務�����;受聘為Frontiers in Physiology(Q1)/Heliyon(Q2)雜志副主編�;為40多種國際知名期刊特邀審稿專家����,國家自然科學基金會評專家,科技部項目評審專家��。主持澳大利亞長江奮進獎項目���、德國洪堡研究基金課題����、國家重點研發(fā)計劃課題�、國家自然基金����、國家社科基金等國內(nèi)外研究課題30余項��。以第一作者和/或通訊作者發(fā)表SCI文章90余篇����。為首批國家健康科普專家和首批國家衛(wèi)生健康技術推廣服務專家����,健康報社“2021年度健康傳播影響力人物”、“2023年科普專家?guī)靸?yōu)秀審稿專家”和“2024年科普之光創(chuàng)作者”稱號�����。