如何讓納米藥物更高效地進入腫瘤細胞����,是實現(xiàn)精準(zhǔn)治療的關(guān)鍵一環(huán)。近日��,廈門大學(xué)附屬第一醫(yī)院超聲科張曉東主任與廈門大學(xué)藥學(xué)院霍帥東團隊在超聲控制藥物遞送領(lǐng)域取得最新進展��,首次系統(tǒng)揭示了納米載體顆粒尺寸在超聲增強腫瘤細胞內(nèi)吞過程中的決定性作用�����,為開發(fā)超聲智能響應(yīng)型納米藥物提供了重要的理論指導(dǎo)���。相關(guān)成果研究成果以“Size-dependent ultrasound enhancement of nanoparticle endocytosis in tumor cells”為題發(fā)表于領(lǐng)域權(quán)威期刊 《Ultrasonics Sonochemistry》(中科院一區(qū)Top���,IF=9.7)。
納米藥物的療效高度依賴于其被腫瘤細胞內(nèi)吞的效率��。盡管超聲介導(dǎo)的“聲孔效應(yīng)”已被廣泛用于增強藥物遞送����,但超聲與納米顆粒內(nèi)吞之間的精細相互作用機制,尤其是尺寸如何影響這一過程,一直是該領(lǐng)域待解的謎題����。針對這一關(guān)鍵科學(xué)問題,該團隊在前期系統(tǒng)性工作(Nature Chemistry���,2021�,13���,131��;Angewandte Chemie����,2021��,60�,14707���;Advanced Science, 2022, 9, 2104696等)的基礎(chǔ)上�����,將研究視角從分子與納米尺度的藥物激活延伸至細胞水平的藥物遞送過程��。他們設(shè)計并合成了一系列尺寸在20至100 nm之間的二氧化硅納米顆粒作為納米藥物模型����,系統(tǒng)探究了其在超聲作用下的內(nèi)吞規(guī)律。
實驗結(jié)果顯示:超聲能顯著增強20至80 nm尺寸范圍內(nèi)納米顆粒的細胞內(nèi)吞效率�,且效果呈現(xiàn)出強烈的尺寸依賴性。其中��,40 nm的顆粒在超聲作用下內(nèi)吞效率提升了3.8倍����,表現(xiàn)出最優(yōu)的超聲響應(yīng)性能。進一步的機制研究證明了超聲的雙重作用:不僅可以通過“聲孔效應(yīng)”為納米顆粒打開非能量依賴性的“快速通道”����;更重要的是能夠“解鎖”并激活細胞自身的多種內(nèi)吞途徑,甚至逆轉(zhuǎn)小窩蛋白�����、網(wǎng)格蛋白等多種內(nèi)吞抑制劑的“封鎖”作用�,從而大幅提升納米顆粒的入胞效率。該研究首次系統(tǒng)闡明了納米顆粒尺寸在超聲增強內(nèi)吞過程中的核心地位�,并揭示了超聲通過激活多種內(nèi)吞途徑協(xié)同“聲孔效應(yīng)”促進藥物入胞的雙重機制�����。相關(guān)發(fā)現(xiàn)為設(shè)計具有尺寸可控與超聲響應(yīng)性能的下一代藥物遞送系統(tǒng)提供了數(shù)據(jù)支撐和理論指導(dǎo)�����。
張曉東主任醫(yī)師與霍帥東教授為該論文的共同通訊作者��,藥學(xué)院博士研究生廖志環(huán)���、碩士文梓豪為論文的共同第一作者。廈門大學(xué)附屬第一醫(yī)院超聲影像科��、廈門大學(xué)藥學(xué)院�、福建省藥物新靶點研究重點實驗室為該論文的第一完成單位。該研究獲得了國家自然科學(xué)基金�����、福建省自然科學(xué)基金���、深圳市自然科學(xué)基金及廈門大學(xué)南強青年拔尖人才計劃等多項研究資金的支持。
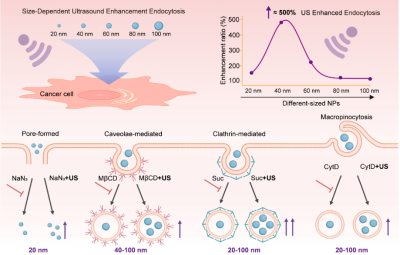
超聲增強納米藥物遞送新機制研究示意圖
文章鏈接:
https://doi.org/10.1016/j.ultsonch.2025.107580