今天為大家分享一篇近期發(fā)表在生物材料學(xué)TOP期刊《Materials Today Bio》的研究�,題目為“Highly efficient NIR-II photothermal therapy amplified ROS oxide breast tumor therapy by mesoporous gallium-enriched platinum nanomedicine”。在這篇文章中����,研究團隊首次提出了一種一步法制備表面修飾有PEG2000的介孔PtGa雙金屬材料(PtGaP),展示了其在近紅外II(1064 nm)激光照射下�����,通過PTT和氧化療法(OXT)的協(xié)同作用���,有效抑制腫瘤生長的能力�����。本文的通訊作者是廈門大學(xué)附屬第一醫(yī)院張福星教授和中國科學(xué)院福建物質(zhì)結(jié)構(gòu)研究所王培園副研究員���,第一作者是中國科學(xué)院福建物質(zhì)結(jié)構(gòu)研究所應(yīng)昀菲碩士研究生和廈門大學(xué)附屬第一醫(yī)院蘇永輝主治醫(yī)師��。

研究背景介紹
鎵(Ga)是人體中的一種微量元素���,通常以三價形式存在,其與鐵(Fe)在離子半徑���、電離勢和電子親和力等方面有許多相似之處�。由于這些化學(xué)性質(zhì)上的相似性���,生物系統(tǒng)往往無法區(qū)分FeIII和GaIII��,這使得GaIII可以替代FeIII參與鐵代謝���,從而干擾其正常功能。盡管GaIII具有臨床益處���,但在生理條件下����,它可能會形成低溶解度和生物利用度的氫氧化鎵(Ga(OH)3),從而限制了其治療效果�����。此外�����,直接接觸游離的GaIII可能導(dǎo)致腎毒性��、腎酸中毒和腎小球損傷等副作用��。
GaII與FeII類似����,可以作為芬頓試劑�,在腫瘤細胞中通過生成活性氧(ROS)來誘導(dǎo)氧化療法(OXT)��。然而����,由于血液循環(huán)缺乏特異性�,GaII載體可能會因GaIII/GaII對的相對較低的氧化還原電位而發(fā)生提前生物氧化。這可能導(dǎo)致過量的過氧化氫產(chǎn)生,并對健康組織造成不良影響���。為了解決這一問題����,研究人員將目光轉(zhuǎn)向了無定形Ga0納米顆粒�,這些顆粒設(shè)計為在酸性的腫瘤微環(huán)境中快速離子化,按需釋放GaII�,使得局部芬頓反應(yīng)得以實現(xiàn),為癌癥治療提供更精準(zhǔn)的方法����。該系統(tǒng)的刺激響應(yīng)特性使治療更加針對腫瘤部位���。雖然單獨使用OXT通常不足以達到最佳治療效果,但將其與其他治療方法結(jié)合使用通常能取得更好的療效�。
協(xié)同治療在腫瘤抑制中已得到廣泛應(yīng)用����。根據(jù)熱力學(xué)分子碰撞理論����,提高局部溫度可以提升芬頓反應(yīng)的效率�����,這使得光熱治療(PTT)成為理想的輔助治療方法。鉑(Pt)納米粒子因其出色的縱向表面等離子體共振�、抗光漂白性和體內(nèi)生物相容性,特別是在近紅外II波段(1000-1700 nm)的特異性吸收��,使其特別適合用于PTT。因此,開發(fā)和優(yōu)化鎵(Ga)和鉑(Pt)共摻雜的納米粒子對乳腺癌治療具有重要意義����。這種方法結(jié)合了兩種FDA批準(zhǔn)的成分,對于推進納米醫(yī)學(xué)的臨床應(yīng)用至關(guān)重要�����。
針對上述關(guān)鍵問題,作者團隊開發(fā)了一種Pt和Ga0雙金屬共摻雜材料��。合成的PtGa具有獨特的介孔納米結(jié)構(gòu)�����,因此比固體材料更大的表面積和更多的活性位點,同時這種納米顆粒能夠有效在乳腺腫瘤區(qū)域積累����,因此成為一種有潛力的芬頓型催化劑����。當(dāng)使用NIR-II(1064 nm)激光照射時��,PtGaP顯示出高光熱轉(zhuǎn)換效率�,局部熱效應(yīng)通過Ga0催化劑促進了ROS的放大。體外和體內(nèi)研究均表明�����,這種雙金屬介孔納米藥物能夠通過PTT和OXT的協(xié)同作用有效抑制腫瘤發(fā)生發(fā)展��。所有這些發(fā)現(xiàn)都強調(diào)了基于Pt和Ga的納米復(fù)合材料作為惡性乳腺癌消融的化學(xué)動力學(xué)納米制劑的潛力����。
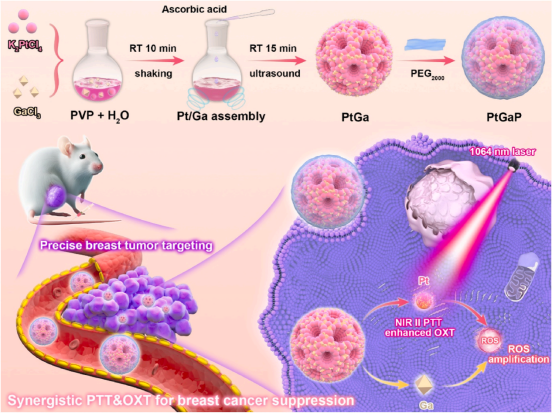
圖 1 一步合成的介孔雙金屬PtGa納米枝晶在1064納米激光照射下���,通過協(xié)同光熱治療(PTT)和光氧化治療(OXT),精準(zhǔn)靶向乳腺腫瘤并進行消融。
研究結(jié)果
介孔PtGaP的體外性能表征
介孔鉑鎵納米顆粒通過一步溶液相反應(yīng)制備�,無需高溫和有機溶劑。納米顆粒使用PVP兩親性表面活性劑�����、K2PtCl4和氯化鎵的金屬共前驅(qū)體以及還原劑AA在室溫下合成����。PtGa納米顆粒分散性良好,平均尺寸約為20納米(圖2A)��。由于其獨特的介孔納米結(jié)構(gòu)�����,PtGa的比表面積通過氮氣吸附-脫附等溫線測定為383.2 cm3/g��。為了延長血液中的循環(huán)時間����,進行了表面PEG化處理(PtGaP)。正是由于這種具有大比表面積的獨特介孔納米結(jié)構(gòu)����,PEG2000分子能夠物理吸附到PtGa的表面�����。電子透射電子顯微鏡(TEM)圖像顯示�,PtGaP的分散性更好�,形態(tài)變化明顯(圖2B)。進一步觀察放大TEM和高分辨率TEM(HRTEM)��,發(fā)現(xiàn)每個納米顆粒的外表面和內(nèi)表面均形成了平均直徑~3納米的介孔(圖2C和D)��。根據(jù)[55]的先前研究�,這些雙金屬納米顆粒是由空間互連的臂組裝而成。最后通過高分辨率掃描透射電子顯微鏡(HR-STEM)���、高角度環(huán)形暗場顯微鏡(HAADF)和元素映射圖像顯示,Ga����、Pt、O在PtGaP納米顆粒中均勻分布(圖2E和F)�����。隨后,ICG分子成功加載到堆疊的介孔中(PtGaP@I)����,其負載效率被定量確定為19.22 ± 2.03 %。顯然�,PtGaP@I中可以成功檢測到ICG的吸收峰(780 nm),這表明它可以用作NIR-II(1000–1700 nm)的生物成像對比劑(圖2M)����。此外,通過NIR-II熒光生物成像系統(tǒng)進一步測量了ICG和PtGaP@I在水中的光穩(wěn)定性��。結(jié)果顯示�����,游離ICG在連續(xù)光照18分鐘后�,其初始熒光強度減少了~92.3 %。相比之下�,PtGaP@I在照射結(jié)束時,幾乎保留了87.8 %的初始信號強度(圖2I和J)���。這些數(shù)據(jù)表明�����,堆疊的介孔能夠顯著穩(wěn)定ICG染料�,防止水分子淬滅,證實了PtGaP@I可以作為NIR-II熒光造影劑使用(圖2G)����。
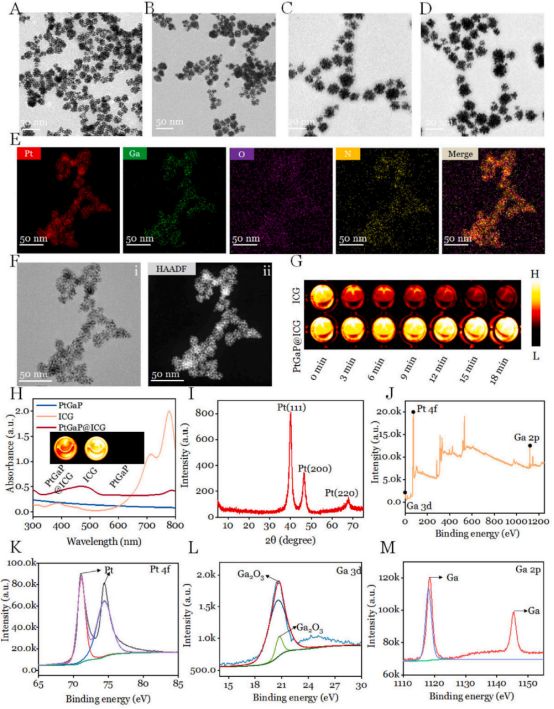
圖 2 (A) PtGa和(B) PtGaP的透射電子顯微鏡圖像。(C) PtGa和(D) PtGaP的高分辨率透射電子顯微鏡圖像����。(E)Pt、Ga����、O、N元素的分布圖及其合并圖像��,(F)PtGa和(G)PtGaP的高分辨率透射電子顯微鏡圖像�。(G)通過808納米激光連續(xù)照射不同時間后ICG(上)和PtGaP@I(下)的近紅外II熒光圖像。(H)PtGa��、ICG和ICG PtGaP@I的吸收光譜及近紅外II發(fā)光圖像(插圖)�����。(I)PtGaP的XRD譜圖�����。(J)全XPS高分辨率圖譜���,包括(K) Pt 4f����、(L) Ga 3d和(M) Ga 2p的光譜�。
介孔PtGaP的ROS生成能力和NIR-II PTT能力驗證
鑒于Ga0和Fe0的相似性,使用3,3,5,5-四甲基聯(lián)苯胺(TMB)在體外測定PtGaP介孔納米結(jié)構(gòu)產(chǎn)生的?OH��。TMB的氧化產(chǎn)物(oxTMB)在645 nm處顯示出強烈的吸收(藍色)����。活性氧的生成效率對PtGaP和過氧化氫有明顯的劑量依賴性(圖3A和B)�。并且反應(yīng)非常迅速,在大約15分鐘內(nèi)達到峰值(圖3C)�。異丙醇(IPA)是一種已知的?OH清除劑,當(dāng)PtGaP與2.0 mg/mL的過氧化氫結(jié)合時�,生成的oxTMB的吸收峰顯示出明顯的IPA濃度依賴性(圖3D)。與非NIR-II激光對照組相比����,PtGaP +過氧化氫加1064 nm激光照射組的?OH生成量增加了2.4倍�,強烈表明納米載體在癌細胞胞漿中具有強大的協(xié)同活性氧放大作用(圖3E)����。
進一步使用紅外相機測量了PtGaP在1064 nm NIR-II激光照射下的升溫曲線。與對照組組(0 μg/mL)相比���,后者顯示的溫度變化最小�����,PtGaP的溫度升高與其濃度有關(guān)(圖3F)��。具體而言����,0.8 mg/mL PtGaP溶液在NIR-II激光照射下5分鐘內(nèi)最大溫差(△T)達到22.3?C���,證實了PtGaP對NIR-II光的快速響應(yīng)(圖3G)���。為了進一步研究其對1064 nm激光的響應(yīng),實驗中應(yīng)用了不同的功率密度����,結(jié)果顯示,隨著功率密度的增加�����,200 mg/mL PtGa溶液的溫度顯著升高(圖3H和I)����。此外,PtGaP在四個激光開關(guān)循環(huán)中表現(xiàn)出優(yōu)異的光穩(wěn)定性(圖3J)����。為了定量評估激光到熱量轉(zhuǎn)換效率(η),分析了加熱/冷卻循環(huán)(激光開關(guān))期間的熱變化(圖3K)��。根據(jù)已建立的公式��,計算出PtGaP的η約為43.11 %�。綜上所述,這些結(jié)果突顯了介孔PtGa納米平臺作為NIR-II激光誘導(dǎo)光熱增強OXT的有前景的納米藥物的潛力��。
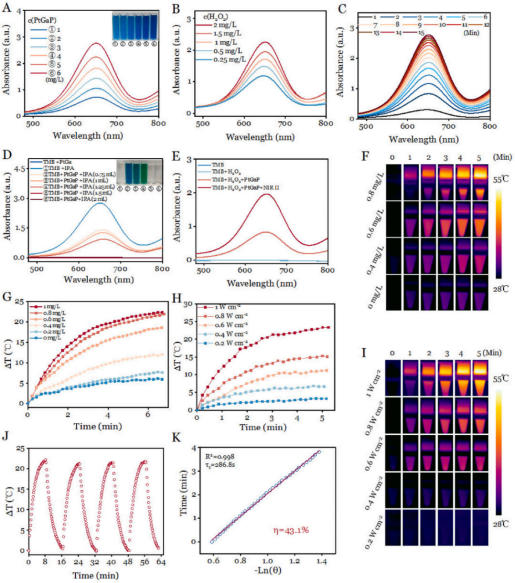
圖 3 (A)紫外-可見吸收光譜和數(shù)碼照片(插圖)展示了在不同濃度的PtGaP存在下����,TMB與0.5 mg/L過氧化氫共孵育后生成的oxTMB���。(B)TMB在與PtGaP(3 mg/L)及不同過氧化氫劑量孵育后隨時間變化的吸收光譜。(C)TMB在與PtGaP(3 mg/L)及過氧化氫(0.5 mg/L)孵育不同時間后的紫外-可見吸收光譜��。(D)TMB在與不同配方及各種濃度的IPA孵育后的紫外-可見吸收光譜和數(shù)碼照片(插圖)�����。(E)經(jīng)過不同處理后的紫外-可見吸收光譜�����。(F)不同濃度的PtGaP在1064 nm激光照射5分鐘后�����,紅外熱成像和溫度變化曲線����。(G)不同功率密度下,PtGaP在1064 nm激光照射下的溫度變化曲線和紅外熱成像�����。(H)PtGaP在四個激光開/關(guān)循環(huán)中的溫度變化�。(K)冷卻時間和-Ln(θ)之間的線性關(guān)系����。
介孔PtGaP在細胞水平上的性能評價
在這項研究中��,作者團隊首次開發(fā)了介孔PtGaP納米藥物���,因此需要評估其對正常細胞和腫瘤細胞的生物相容性。隨著濃度的增加�����,PtGaP在治療12小時后對4T1細胞的細胞毒性顯著增強���。當(dāng)濃度達到100 μg/mL時�,4T1細胞的存活率僅為39 %�����,而正常胃黏膜上皮細胞(GES-1)的存活率是4T1細胞的兩倍(圖4A)��。這表明納米藥物具有針對腫瘤細胞的特異性殺傷作用����。此外����,進一步研究了PtGaP���、磷化鎵和PtP在連續(xù)NIR-II激光照射(5分鐘�,1 W/cm2)下對腫瘤細胞(過氧化氫預(yù)處理)的細胞殺傷效果���。如圖4B所示���,PtGaP + L組的存活率顯著低于僅接受PtGaP治療的組。值得注意的是�,在300 μg/mL和400 μg/ mL的濃度下,4T1細胞的存活率分別僅為27 %和14 %����。
為了更清晰地觀察PtGaP在細胞內(nèi)的分布,我們使用FITC染料(激發(fā)波長488納米�,發(fā)射波長550納米)對這種介孔納米結(jié)構(gòu)進行了標(biāo)記。隨后�,通過CLSM和流式細胞術(shù)評估了4T1細胞對PtGaP的攝取效率。值得注意的是���,隨著時間的推移�,細胞質(zhì)中的綠色信號逐漸增強,證實了PtGaP的內(nèi)吞作用是時間依賴性的(圖4F)�。流式細胞術(shù)的結(jié)果與CLSM觀察結(jié)果一致,顯示了類似的時間依賴性模式���,內(nèi)吞作用在4小時時達到飽和(圖4E和C)��。
此外�����,作者團隊通過定性評估PtGaP孵育4小時后細胞內(nèi)的ROS水平進一步探索了腫瘤細胞破壞的潛在機制。首先��,細胞被隨機分為八個組(圖4D)���。經(jīng)過不同的處理后���,使用商用指示劑2′,7′-二氯熒光素二乙酸酯(DCFH-DA�,激發(fā)波長488 nm,發(fā)射波長550 nm)測量細胞內(nèi)的ROS生成����。隨后通過流式細胞術(shù)和CLSM量化細胞的熒光強度��。如圖4G所示�����,對照組和PBS + L組的熒光水平相似�,而PtGaP處理的細胞顯示出大約四倍的ROS生成��。值得注意的是���,預(yù)孵育100 μM過氧化氫的PtGaP+L處理的腫瘤細胞中的胞漿ROS水平比僅PtGaP組高出2.7倍�����,強烈證實了在NIR-II激光照射下腫瘤微環(huán)境中增強的OXT效應(yīng)����。正如預(yù)期���,用PtGaP +過氧化氫加1064納米激光照射處理的腫瘤細胞顯示出最強的綠色信號����,比PtGaP +過氧化氫和PtGaP + L組更為顯著(圖4H)。這些結(jié)果共同證實�,新型PtGaP納米藥物能夠被腫瘤細胞有效內(nèi)化,并在近紅外II光照射和高過氧化氫條件下通過強大的活性氧生成觸發(fā)細胞死亡�。
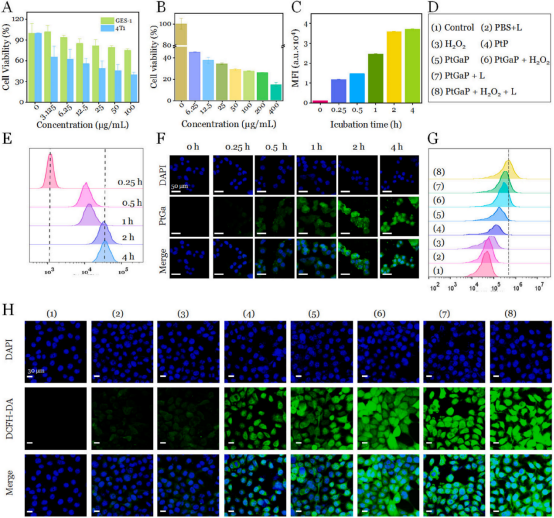
圖 4 (A)各種濃度的PtGaP處理12小時后,4T1和GES-1細胞的存活率����。(B)經(jīng)PtGaP、NIR-II激光照射和過氧化氫處理后的4T1細胞存活率�。(C)4T1細胞在不同時間點與PtGaP孵育后的平均熒光強度。(D)細胞分組用于ROS生成研究����。(E)通過流式細胞術(shù)分析,(F)通過共聚焦激光掃描顯微鏡(CLSM)分析�,4T1細胞在不同時間點與PtGaP(用FITC標(biāo)記)孵育后的變化�����。(G)通過流式細胞術(shù)分析�,(H)通過共聚焦激光掃描顯微鏡(CLSM)分析,4T1細胞在八種不同處理后的細胞質(zhì)ROS水平����。
線粒體是重要的細胞器,其損傷可以直接觸發(fā)線粒體的內(nèi)在凋亡途徑。為了研究PtGaP引起的線粒體功能障礙���,作者團隊首先使用JC-1染色評估線粒體膜電位(圖5A和B)�。在孵育4小時后����,對照組、PBS組和過氧化氫組的4T1細胞未顯示出顯著的綠色熒光(表明線粒體受損)��,而紅色熒光則非常豐富(表明線粒體正常)��。相比之下���,PtP�����、PtGaP和PtGaP +過氧化氫處理后�����,紅色熒光消失�����,綠色熒光增加(細胞質(zhì)中的單體增多)�����。值得注意的是�,PtGaP + L +過氧化氫組的綠色信號顯著增強,表明線粒體功能障礙最為嚴(yán)重����,與PtGaP +過氧化氫組相比,聚集體與單體的比例降低了2.5倍(圖5C)�����。進一步的流式細胞術(shù)分析顯示���,JC-1染色的4T1細胞中存在線粒體特異性的OXT觸發(fā)損傷(圖5F)�����。在PtGaP +過氧化氫組中,使用1064納米激光照射后��,線粒體膜功能障礙的聚集體與單體比例比PtGaP +過氧化氫組高出2.3倍���。這些流式細胞術(shù)結(jié)果與CLSM成像觀察到的趨勢高度一致��。鑒于細胞活力研究中觀察到的顯著細胞死亡率�����,使用CLSM捕捉活/死細胞的綠色/紅色熒光以區(qū)分細胞狀態(tài)���。如圖5D和G所示����,PBS組和僅激光組未檢測到明顯的損傷��。令人驚訝的是���,PtGaP + H2O2+L組中僅有11 %的細胞存活��,與PtGaP +過氧化氫組相比�����,癌細胞死亡率增加了近3.3倍��。這表明�,雖然OXT具有一定的細胞消除能力,但近紅外II型光熱治療(NIR-II PTT)誘導(dǎo)的OXT放大顯著增強了細胞死亡���。此外����,凋亡/壞死分析顯示��,PtGaP誘導(dǎo)的死亡率較低���,大約20 %的細胞發(fā)生凋亡(圖4E-H)��,進一步證明了其出色的生物相容性�。所有這些發(fā)現(xiàn)表明�,基于PtGaP的納米平臺與激光照射結(jié)合使用,可以特異性地在高過氧化氫條件下協(xié)同抑制癌細胞增殖�����,使PtGaP成為一種有前途的NIR-II PTT/OXT納米劑��,用于臨床乳腺癌治療�����。
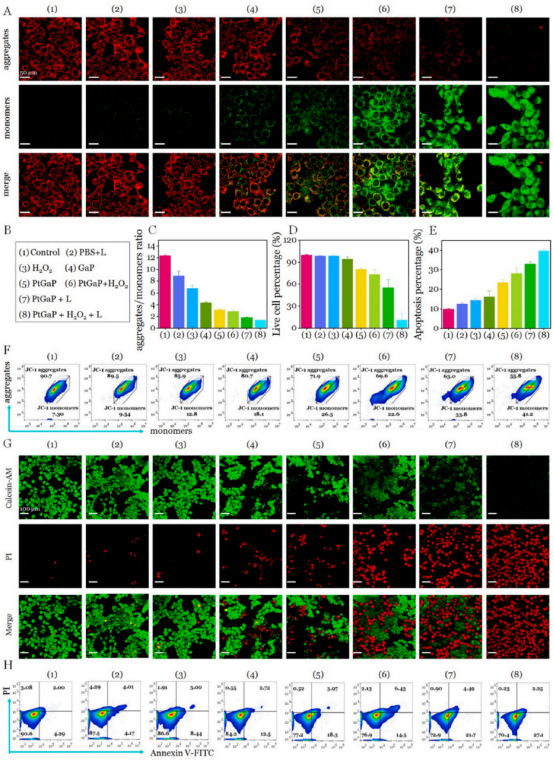
圖 5 (A)經(jīng)八種不同處理后�,JC-1染色的4T1細胞的CLSM圖像。(B)細胞分組:用于JC-1染色��、CLSM成像和流式細胞術(shù)分析的細胞分組����。(C)各種處理后,JC-1染色的4T1細胞的聚集體與單體比例����。(D)不同處理后4T1細胞中活細胞的比例。(E)不同處理后4T1細胞的凋亡百分比����。(F)不同處理后,JC-1染色的4T1細胞的流式細胞術(shù)分析���。(G)經(jīng)八種配方處理后����,4T1細胞的活/死細胞的CLSM圖像����。(H)不同處理后4T1細胞的流式細胞術(shù)分析�。
介孔PtGaP的體內(nèi)靶向能力和NIR-II PTT評價
受到PtGaP在體外腫瘤細胞識別和治療診斷潛力的啟發(fā)��,作者團隊旨在研究這種納米平臺在體內(nèi)的成像特性�����。作者團隊通過NIR-II熒光成像技術(shù)�����,在攜帶4T1乳腺腫瘤的Balb/C小鼠中評估其生物分布和腫瘤靶向效果��。如圖6A所示����,小鼠靜脈注射自由ICG或PtGaP@I后,使用小型動物成像系統(tǒng)進行成像�����。熒光信號在腫瘤部位逐漸累積�,在注射后3小時達到峰值。48小時時���,腫瘤區(qū)域(用虛線圈標(biāo)出)清晰可見�,信號逐漸減弱,到72小時時變得微弱����。相比之下�,對照組中自由ICG在腫瘤部位的熒光幾乎可以忽略不計,即使在240小時后也是如此�。正如預(yù)期,PtGaP@I組的腫瘤相關(guān)性(TNR)顯著高于僅使用ICG的組(圖6B)�。值得注意的是,注射后48小時���,PtGaP@I組的TNR最高�,幾乎是ICG組的16.5倍���。此外�����,注射后24小時的離體NIR-II熒光成像顯示�����,與ICG組相比�����,PtGaP@I組的實體乳腺腫瘤表現(xiàn)出最高的腫瘤積累和最少的網(wǎng)狀內(nèi)皮系統(tǒng)(RES)器官攝?。▓D6C和D)?��;谶@些發(fā)現(xiàn)�����,進一步測量了兩組在1064納米光照射下����,注射PtGaP@I和ICG后48小時的局部腫瘤溫度�����。在PtGaP@I組中��,溫度迅速上升��,在連續(xù)NIR-II照射5分鐘后達到約60?C的峰值�����。相比之下,ICG處理組在相同條件下僅表現(xiàn)出~41?C的溫度升高(圖6E和F)��。由于精確的腫瘤靶向和最小的RES吸收���,PtGaP@I納米藥物緩解了對潛在系統(tǒng)毒性的擔(dān)憂����。雖然50?C以上的溫度對腫瘤消融有效����,但不會對周圍正常組織造成顯著損害�����。與用于乳腺癌治療的其他鉑基納米粒子相比���,PtGaP納米平臺憑借其精準(zhǔn)的腫瘤蓄積能力����,可實現(xiàn)腫瘤診斷的增強和協(xié)同治療的有效性���。
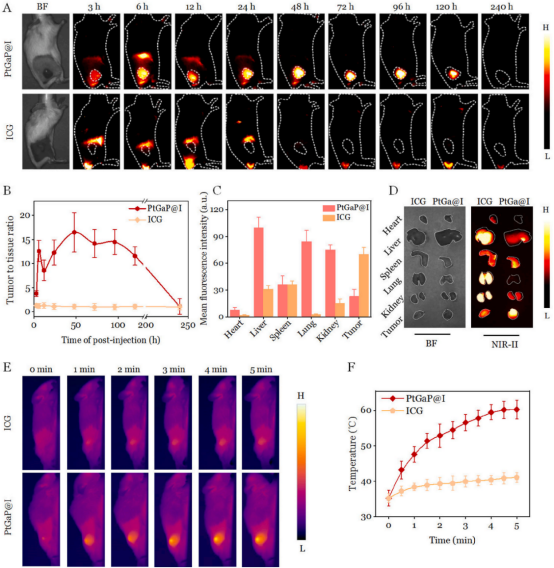
圖 6 (A)不同時間點通過靜脈注射PtGaP@I或ICG處理的小鼠乳腺腫瘤模型的近紅外二區(qū)(NIR-II)熒光成像結(jié)果�����,虛線圓圈標(biāo)記腫瘤部位����。(B)基于(A)生成的TNR數(shù)據(jù)。(C)PtGaP@I和ICG處理小鼠注射后24小時主要器官及腫瘤的定量熒光強度與離體熒光圖像����。(E)PtGaP@I或ICG注射48小時后,經(jīng)1064 nm光照5分鐘的乳腺腫瘤小鼠熱成像圖及(F)溫度升幅曲線���。數(shù)據(jù)以均值±標(biāo)準(zhǔn)差表示(n=5)��。
介孔PtGaP的體內(nèi)協(xié)同NIR-II PTT&OXT
基于作者團隊研發(fā)的PtGaP納米平臺在體外細胞殺傷能力和腫瘤富集特性�,研究人員建立了4T1腫瘤異種移植小鼠模型�,以進一步評估NIR-II光熱/光氧化療法與PtGaP的體內(nèi)協(xié)同治療效果。為驗證治療假設(shè)���,對皮下植入骨肉瘤的小鼠分別使用四種不同制劑(PBS�����、PBS + L����、PtGaP、PtGaP + L)進行治療����。如圖7A-D所示,PBS組和PBS+1064 nm激光治療組在整個治療期間腫瘤生長迅速�,表明1064 nm激光(5分鐘,1.0W/cm2)對抑制腫瘤的作用微乎其微�����。相比之下�����,PtGaP治療組表現(xiàn)出更顯著的抑瘤效果��,其腫瘤體積和重量均明顯優(yōu)于PBS組����。值得注意的是�,PtGaP + L組幾乎完全抑制了腫瘤生長��,其腫瘤增長率顯著低于其他組別(圖7E)�。這種增強的清除效率可歸因于1064 nm光照下光熱誘導(dǎo)的活性氧(ROS)擴增產(chǎn)生的協(xié)同效應(yīng)�。腫瘤組織最終通過H&E染色、TUNEL檢測和Ki67抗體染色進行分析���。如圖7G所示��,PtGaP + L組的H&E染色顯示細胞核染色質(zhì)高度凝聚����,壞死腫瘤細胞區(qū)域最大��。TUNEL免疫組化分析表明�,該組細胞凋亡和壞死細胞數(shù)量較其他組顯著增加。此外����,作為廣泛認(rèn)可的細胞增殖標(biāo)志物,PtGaP + L組的Ki67表達量明顯降低����,進一步證實了基于PtGaP的光熱/光氧化協(xié)同療法在近紅外II型光照射下取得的優(yōu)異腫瘤抑制效果。各組小鼠體重變化幅度極小�,經(jīng)PtGaP納米平臺聯(lián)合激光治療的小鼠主要器官均未觀察到顯著組織病理學(xué)異常(圖7F)�。因此��,本研究中低劑量鎵摻雜不會產(chǎn)生毒性問題�����。
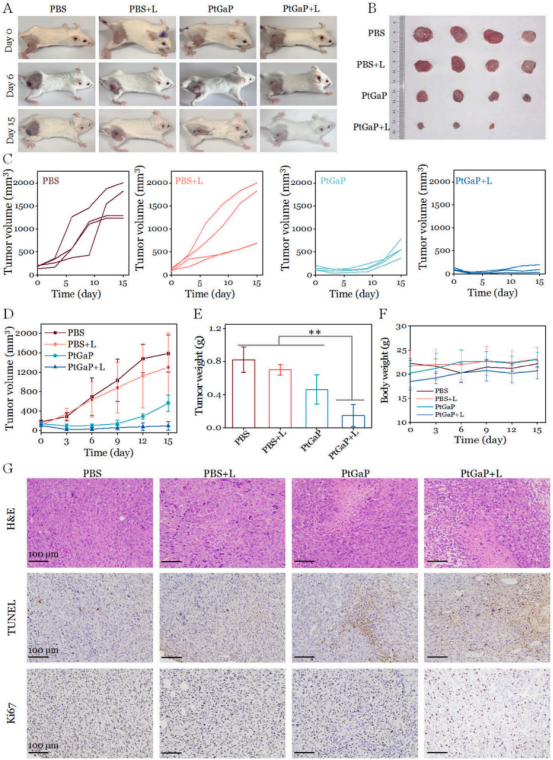
圖 7 (A)經(jīng)不同治療15天后攜帶乳腺癌的小鼠具有代表性的數(shù)碼照片����。(B)各治療組切除腫瘤15天后的照片。(C)PBS����、PBS + L、PtGaP及PtGaP + L治療組小鼠個體腫瘤生長曲線����。(D)不同治療組的腫瘤體積變化曲線及(F)體重變化情況���。(E)各治療組切除腫瘤15天后的重量數(shù)據(jù)�����。(G)不同治療組切除腫瘤15天后的H&E染色�����、Ki67標(biāo)記及TUNEL檢測結(jié)果����。**p < 0.01,標(biāo)準(zhǔn)差(n = 4��,均值±標(biāo)準(zhǔn)差)�����。
結(jié)論
綜上所述��,作者團隊通過一步溶液相反應(yīng)成功制備出具有單分散直徑的介孔PtGa納米劑���,經(jīng)表面聚乙二醇化處理后�����,PtGaP納米藥物不僅展現(xiàn)出源自鉑基(Pt)的優(yōu)異近紅外II波段光熱轉(zhuǎn)換性能���,還通過鎵基(Ga)催化劑實現(xiàn)了顯著的類芬頓催化活性。憑借精準(zhǔn)的腫瘤細胞靶向性和優(yōu)越的形貌特征����,在近紅外II波段光照下�,通過熱激活可觸發(fā)大量活性氧(ROS)生成����。在體外和體內(nèi)實驗中,該納米平臺通過光熱協(xié)同效應(yīng)(OXT)與近紅外II波段光熱治療(PTT)的組合��,在1064 nm光照射條件下展現(xiàn)出顯著的腫瘤殺傷效果�����。
本研究提出的納米平臺為協(xié)同應(yīng)用光熱與近紅外II波段光熱療法提供了一種創(chuàng)新性解決方案����,可有效抑制惡性腫瘤生長。
原文鏈接:www.journals.elsevier.com/materials-today-bio
通訊作者簡介

張福星���,廈門大學(xué)附屬第一醫(yī)院院長�����,主任醫(yī)師,教授���,博士生導(dǎo)師�,廈門市本土領(lǐng)軍人才。中國醫(yī)師協(xié)會外科醫(yī)師分會委員�,中國醫(yī)促會理事、外科學(xué)分會常委兼副秘書長���,全國衛(wèi)生產(chǎn)業(yè)企業(yè)管理協(xié)會疝和腹壁外科產(chǎn)業(yè)及臨床研究分會常務(wù)理事兼第26專家組組長����,世界內(nèi)鏡醫(yī)師協(xié)會疝和腹壁外科協(xié)會常務(wù)理事�,內(nèi)鏡臨床診療質(zhì)量評價專家委員會委員,中國研究型醫(yī)院學(xué)會甲狀腺疾病專業(yè)委員會委員�����,福建省醫(yī)學(xué)會外科學(xué)分會常委���,福建省海峽腫瘤防治科技交流協(xié)會常務(wù)理事兼甲狀腺腫瘤分會主任委員����,福建省醫(yī)師協(xié)會普通外科醫(yī)師分會腔鏡甲狀腺學(xué)組副組長,海峽兩岸醫(yī)藥交流協(xié)會臺海醫(yī)學(xué)會常委�,廈門市醫(yī)學(xué)會甲狀腺外科學(xué)分會主任委員。擔(dān)任《中華疝與腹壁外科雜志》編委,《中華內(nèi)分泌外科雜志》編委����。

王培園,中國科學(xué)院福建物質(zhì)結(jié)構(gòu)研究所�����,副研究員��,2017年于復(fù)旦大學(xué)化學(xué)系獲得博士學(xué)位����。2018年加入中國科學(xué)院福建物質(zhì)結(jié)構(gòu)研究所。主要從事近紅外二區(qū)熒光探針的制備和腫瘤微環(huán)境響應(yīng)性熒光成像導(dǎo)航腫瘤的精準(zhǔn)切除����。主持國家自然科學(xué)基金青年項目。近年來在Nature Communications, Journal of the American Chemical Society, Angewandte Chemie International Edition, Advanced Functional Materials, ACS Nano等國際頂級期刊發(fā)表50余篇SCI論文����。
第一作者簡介

應(yīng)昀菲,南華大學(xué)2022級生物學(xué)研究生����,導(dǎo)師中國科學(xué)院福建物質(zhì)結(jié)構(gòu)研究所王培園副研究員����,碩博在讀期間以第一作者/共同第一作者在ACS Nano��、Adv. Functional Materials���、ACS Materials Letters、Materials Today Bio等國際權(quán)威期刊發(fā)表研究論文多篇,多次獲得研究生國家獎學(xué)金���。

蘇永輝�,廈門大學(xué)附屬第一醫(yī)院乳腺外科�,主治醫(yī)師,醫(yī)學(xué)博士���。畢業(yè)于復(fù)旦大學(xué)上海醫(yī)學(xué)院�����,師從國內(nèi)著名乳腺外科專家吳炅教授�。福建省及廈門市高層次人才(C類)?,F(xiàn)任福建省海醫(yī)會乳腺腫瘤微無創(chuàng)分會青委會委員,福建省海峽腫瘤防治交流協(xié)會乳腺腫瘤防治分會青委會委員�����,廈門市醫(yī)學(xué)會乳腺病學(xué)分會委員,廈門市抗癌協(xié)會乳腺癌專業(yè)委員會委員���。主持國家自然科學(xué)基金項目一項���,福建省自然科學(xué)基金項目一項。以第一作者/通訊作者在Materials Today Bio�����、Journal of Translational Medicine�����、npj Breast Cancer����、The Breast、CANCER�、The Oncologist等國際權(quán)威期刊發(fā)表多篇論著。