近期���,廈門大學附屬第一醫(yī)院乳腺外科蘇永輝博士聯(lián)合西南醫(yī)科大學附屬醫(yī)院團隊,在生物學TOP期刊《Journal of Nanobiotechnology》(中科院一區(qū)����,IF:12.6),發(fā)表了題為“Tumor-microenvironment triggered Mn-Gd based nanosystem for breast carcinoma suppression via synergistic radiotherapy and glutathione-depleting along with glucose oxidase combination enhanced ROS storm”的重要研究成果���。該研究開發(fā)了一種病毒仿生結構的Mn-Gd雙金屬納米平臺(VMn-Gd@GOx-EVs)�,通過腫瘤微環(huán)境響應性釋放金屬離子���、消耗谷胱甘肽(GSH)�����、生成過氧化氫(H2O2)并緩解腫瘤缺氧��,實現(xiàn)了放療(RT)與氧化療法(OXT)的高效協(xié)同�,顯著增強了對乳腺癌的抑制效果。

一�����、研究背景介紹
乳腺癌是全球女性中最常見的惡性腫瘤����,放療是其重要的治療手段之一。然而�,腫瘤微環(huán)境(TME)中的缺氧、高濃度GSH和高葡萄糖代謝等特點常導致放療抵抗���,限制其療效�����。近年來���,功能性納米材料作為放射增敏劑受到廣泛關注。釓(Gd)基納米材料因其優(yōu)異的X射線衰減能力被用于增強放療���,但其生物降解性和腫瘤穿透性較差��。
病毒仿生納米顆粒具有良好的穿透性���、生物識別能力和免疫激活潛力����。本研究團隊前期開發(fā)了一種具有粗糙表面的中空介孔Mn-Gd基納米球���,模擬病毒結構��,增強細胞膜結合和藥物遞送效率。為進一步克服TME的限制�,本研究引入葡萄糖氧化酶(GOx)和細胞外囊泡(EVs)涂層,構建了多功能納米平臺VMn-Gd@GOx-EVs��,實現(xiàn)腫瘤靶向�、微環(huán)境響應、GSH消耗��、O?生成和ROS風暴誘導的協(xié)同治療��。
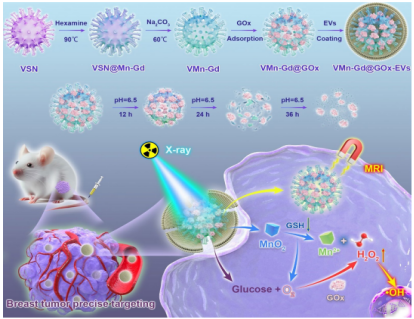
二���、納米平臺設計與構建
VMn-Gd@GOx-EVs的制備采用硬模板法(圖1A)��。首先合成病毒樣介孔二氧化硅模板(VSN)���,在其表面通過水熱法形成MnO2-Gd2O3雜化殼(VSN@Mn-Gd)�����,隨后去除模板得到中空病毒樣Mn-Gd納米顆粒(VMn-Gd)���。GOx通過物理吸附負載于VMn-Gd表面,最后通過電穿孔法將EVs膜包裹于納米顆粒外部��,形成VMn-Gd@GOx-EVs��。

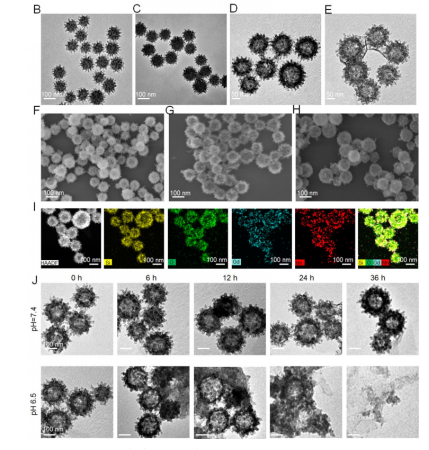
TEM和SEM圖像顯示��,VMn-Gd保留了病毒樣的刺突結構(圖1B–H)���,元素映射證實Si�����、O�、Mn、Gd均勻分布(圖1I)���。在酸性條件(pH 6.5)下�,納米顆粒表現(xiàn)出時間依賴性降解�,36小時后完全崩解釋放約10 nm的小顆粒,顯著增強腫瘤穿透能力(圖1J)����。GOx在pH 6.5下的釋放效率是pH 7.4的7倍以上,表明其良好的腫瘤微環(huán)境響應性�����。
三����、MRI性能與體外ROS生成能力
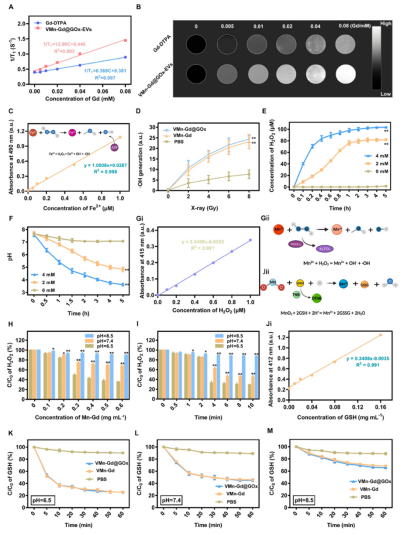
由于Mn和Gd離子在酸性TME中釋放�,VMn-Gd@GOx-EVs表現(xiàn)出優(yōu)異的T?加權MRI對比效果,r?弛豫率為12.90 mM?1s?1���,是臨床常用對比劑Gd-DTPA的2倍(圖2A–B)�。使用APF探針檢測·OH生成�,發(fā)現(xiàn)VMn-Gd@GOx在X射線照射下(8 Gy)產(chǎn)生的?OH顯著高于對照組�,且具有劑量依賴性(圖2C–D)��。
GOx在葡萄糖存在下快速生成H2O2并降低pH(圖2E–F)�����,促進VMn-Gd降解和Mn2?介導的類芬頓反應��。在弱酸性條件下(pH 6.5)�,H2O2分解效率是pH 8.5的2.5倍(圖2H–I)。DTNB檢測顯示�,VMn-Gd@GOx在pH 6.5下10分鐘內即可顯著消耗GSH(圖2K–M),為ROS風暴創(chuàng)造有利條件��。
四�、體外細胞殺傷機制研究
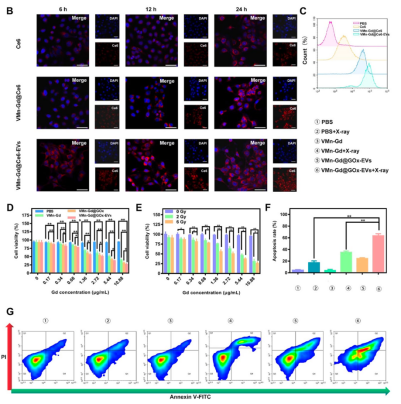
4T1乳腺癌細胞對VMn-Gd@Ce6-EVs的內吞效率顯著高于游離Ce6和未包EVs的納米顆粒(圖3B-C),表明EVs涂層增強細胞攝取和靶向性�����。CCK-8實驗顯示���,VMn-Gd@GOx-EVs聯(lián)合X射線(6 Gy)照射后細胞存活率僅為26.12%�,凋亡率高達61.20%(圖3D–G)���。
GOx催化葡萄糖消耗導致缺氧��,誘導HIF-1α表達上調����;而Mn2?介導的O?生成和GSH消耗則緩解缺氧并增強放療敏感性(圖4A-B, G)。γ-H2AX熒光和Western blot分析證實VMn-Gd@GOx-EVs + X射線組DNA損傷最顯著(圖4C–D, G–J)���?��?寺⌒纬蓪嶒烇@示該組克隆形成率僅為7.73%,顯著低于其他組(圖4E–F)�。
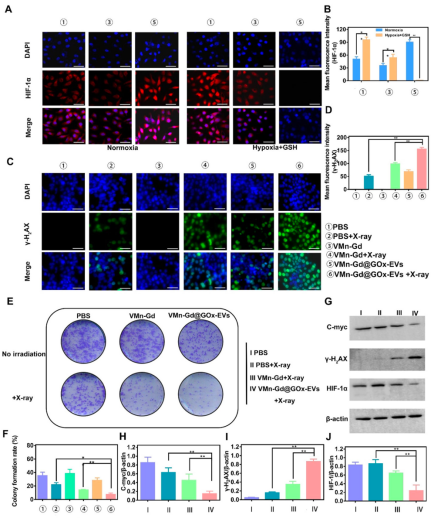
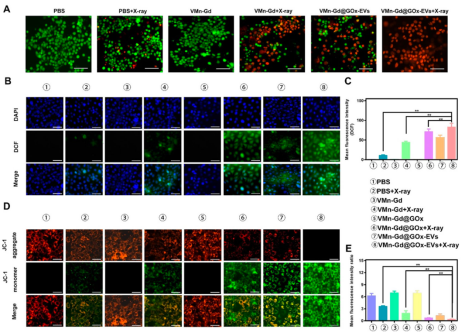
JC-1和DCFH-DA染色進一步證實,VMn-Gd@GOx-EVs + X射線處理導致線粒體膜電位下降和ROS水平顯著升高(圖5)�����,協(xié)同誘導腫瘤細胞死亡���。
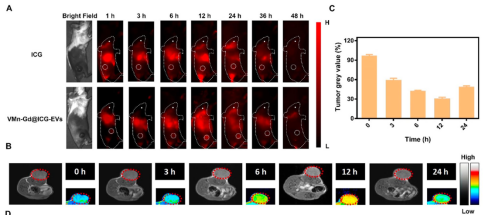
五、體內靶向與治療效果
在小鼠4T1乳腺癌模型中��,VMn-Gd@ICG-EVs注射后12小時腫瘤部位NIR熒光和MRI信號達到峰值(圖6A-C)�����,表明良好的腫瘤靶向和富集能力。
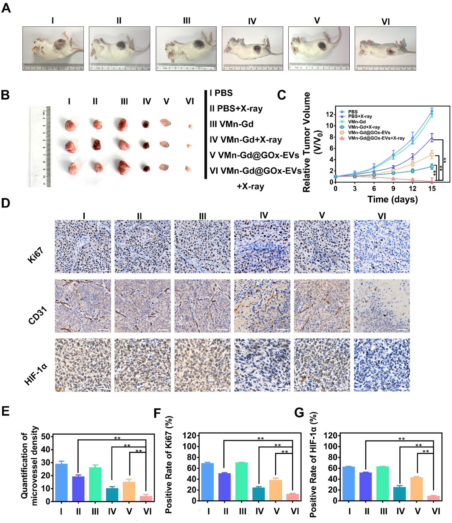
X射線照射12小時后進行放療�,VMn-Gd@GOx-EVs + X射線組腫瘤生長抑制效果最佳,腫瘤體積最?。▓D7A-C)。免疫組化顯示該組Ki67����、CD31和HIF-1α表達顯著降低(圖7D-G),表明增殖抑制�、血管破壞和缺氧緩解。
六����、生物安全性評價
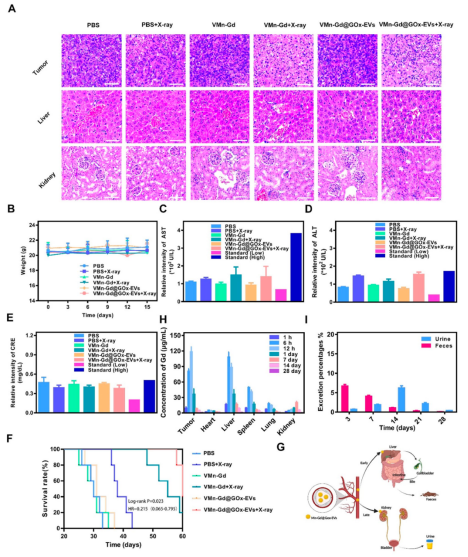
小鼠體重、血清生化指標(AST���、ALT��、CRE)和血細胞計數(shù)均在正常范圍內�,主要器官未見明顯病理損傷(圖8A-E)����。生存分析顯示����,VMn-Gd@GOx-EVs + X射線組小鼠生存期超過60天����,顯著優(yōu)于其他組(圖8F)。納米顆粒主要通過肝脾代謝��,最終通過糞便和尿液排出(圖8G-I)���,且EVs包覆有效避免免疫識別和細胞因子風暴����。
七�����、總結
本研究成功構建了一種多功能�、TME響應的病毒仿生納米平臺VMn-Gd@GOx-EVs,通過EVs靶向�����、TME響應的離子釋放�、GOx介導的葡萄糖消耗與H2O2生成、Mn2?催化的類芬頓反應以及通過協(xié)同放療�����、氧化治療和免疫調節(jié)�,顯著抑制了乳腺癌生長,實現(xiàn)了高效的ROS風暴誘導和腫瘤協(xié)同治療��,并具備良好的成像能力和生物安全性�,展現(xiàn)出廣闊的臨床轉化前景。
原文鏈接:https://doi.org/10.1186/s12951-025-03636-z

蘇永輝�,廈門大學附屬第一醫(yī)院乳腺外科,主治醫(yī)師�����,醫(yī)學博士���。畢業(yè)于復旦大學上海醫(yī)學院�����,師從國內著名乳腺外科專家吳炅教授�����。福建省及廈門市高層次人才(C類)?����,F(xiàn)任福建省海醫(yī)會乳腺腫瘤微無創(chuàng)分會青委會委員�,福建省海峽腫瘤防治交流協(xié)會乳腺腫瘤防治分會青委會委員,廈門市醫(yī)學會乳腺病學分會委員��,廈門市抗癌協(xié)會乳腺癌專業(yè)委員會委員��。主持國家自然科學基金項目一項��,福建省自然科學基金項目一項�����。以第一作者/通訊作者在Journal of Nanobiotechnology��、Materials Today Bio�����、Journal of Translational Medicine�����、npj Breast Cancer、The Breast��、CANCER���、The Oncologist等國際權威期刊發(fā)表多篇論著。