廈門大學(xué)附屬第一醫(yī)院倫理系統(tǒng)使用注意事項
1.在倫理系統(tǒng)https://www.xddyec.com:90/注冊賬號時���,倫理系統(tǒng)的登錄名不可設(shè)置為郵箱地址或者其他較為復(fù)雜的登錄名��,以防無法正常登錄倫理系統(tǒng)�����。完成注冊后����,大家不會收到短信或郵件通知�����,可間隔半個工作日后以初始密碼“1”登錄����。
2.請大家不要在倫理系統(tǒng)重復(fù)注冊賬號,每個人僅限一個賬號��,以防授權(quán)時混亂����。若賬號相關(guān)信息需要變更的,如涉及的角色��、聯(lián)系電話��、郵箱等,可以在系統(tǒng)界面右上方點擊姓名自行修改,或聯(lián)系倫理秘書進行修改��。
3.首次遞交的初始審查項目需要相應(yīng)CRA/SSU/CRC/主要研究者在倫理系統(tǒng)中進行創(chuàng)建����,繼任CRA/CRC需秘書收到繼任人員的授權(quán)與資質(zhì)材料備案后進行授權(quán)才能在倫理系統(tǒng)中看到項目資料。
4.CRC/CRA在注冊賬號有上傳相應(yīng)授權(quán)書及資質(zhì)材料的�,因系統(tǒng)無法自動關(guān)聯(lián)相應(yīng)項目,因此遞交初始審查材料時仍需按“遞交文件清單”上傳CRA/CRC的授權(quán)書及資質(zhì)材料���。更換![]() CRC/CRA時��,前任CRC/CRA應(yīng)先以備案的形式遞交新任CRC/CRA的授權(quán)委托書�����、資質(zhì)材料(GCP證書應(yīng)是最新版GCP培訓(xùn)證書)���,并確保新任CRC/CRA已在倫理系統(tǒng)注冊了賬號。
CRC/CRA時��,前任CRC/CRA應(yīng)先以備案的形式遞交新任CRC/CRA的授權(quán)委托書�����、資質(zhì)材料(GCP證書應(yīng)是最新版GCP培訓(xùn)證書)���,并確保新任CRC/CRA已在倫理系統(tǒng)注冊了賬號。
5.初始審查的項目需自行在倫理系統(tǒng)“項目信息”下新增項目�����,并請確保“項目名稱”與研究方案名稱一致�����,否則將影響到后續(xù)一系列表單中項目名稱的正確性,尤其是倫理意見及倫理批件中的項目名稱�。研究開展過程中,若項目名稱或申辦方信息�����、主要研究者等有變更���,需在倫理系統(tǒng)“項目信息”中進行相應(yīng)的更改。
6.項目信息中“CRO信息”��、"CRC信息”等必填項��,若無或不適用��,直接填寫“無”或“不適用”即可��。
7.《初始審查申請》——“項目研究人員列表”中的應(yīng)包括主要研究者�����、研究醫(yī)生����、研究護士的相關(guān)信息�����。
8.遞交文件若涉及簽字頁��,請確保簽字頁已完成相應(yīng)簽字�。
9.確保上傳倫理系統(tǒng)的文件(除倫理審查申請表等在倫理系統(tǒng)上填寫的表單外)是字跡清晰���、已簽字蓋章的掃描件����,且均為PDF格式�����。加蓋的章應(yīng)為申辦方或被授權(quán)委托方的公章��,若加蓋的為“臨床試驗專用章”或其他章�,應(yīng)附相應(yīng)公司的用章說明,用章說明應(yīng)加蓋相應(yīng)公司的公章���。
10.除項目層面安全性信息報告中的項目層面SUSAR/SAE個例報告表可上傳壓縮文件外�����,其余資料均不可上傳壓縮文件���;若文件掃描后過大���,可分開上傳。
11.根據(jù)遞交文件清單上傳相應(yīng)資料時��,請注意文件名的命名與實際遞交文件內(nèi)容相符����,版本號及版本日期備注正確�����;相關(guān)說明要有出具說明的單位名稱����、日期,并加蓋相應(yīng)單位的公章���。
12.組長單位的倫理審查意見或備案回執(zhí)最好按意見號�����、簽收日期分開上傳�,并在文件名中備注清楚意見號/批件號及日期,若多份意見掃描成一份文件上傳����,則需在文件名中備注清楚涉及的意見號/批件號及日期。
13.國家藥監(jiān)局藥物臨床試驗批件/藥物臨床試驗批準(zhǔn)通知書�、國家藥監(jiān)局醫(yī)療器械試驗審批意見單等類似文件上傳的要求同上第9條要求。
14.臨床試驗涉及的合作方相關(guān)資料�,請按公司名稱的不同分開上傳授權(quán)委托書、公司資質(zhì)文件��,文件名中備注公司的全稱���。
15.可能涉及的檢驗報告���、產(chǎn)品說明書等文件也請按產(chǎn)品名稱的不同分開上傳。
16上傳倫理系統(tǒng)的文件應(yīng)設(shè)置完整的頁碼����。
17.初始審查項目遞交至倫理委員會的紙質(zhì)版資料均應(yīng)從倫理系統(tǒng)平臺下載��、打印并加蓋公章�,除倫理審查申請表�����,其他資料倫理秘書形式受理時系統(tǒng)均會加水印���,沒有水印的紙質(zhì)版資料將不會被接收��。
18.倫理系統(tǒng)平臺下載的各類型倫理審查申請表簽字時日期不能回簽����,應(yīng)簽主要研究者簽字當(dāng)天的日期��。
19.研究進展報告請根據(jù)審查頻率提前一個月遞交����,逾期未交的請同時提交一份針對研究進展報告逾期未交的說明(請注意責(zé)任人應(yīng)為主要研究者)��,后續(xù)將逾期遞交研究進展報告作為方案偏離上報�。
20.初始審查及年度定期跟蹤審查匯報PPT請使用從倫理系統(tǒng)![]()
![]() “制度與SOP”——“公告、制度SOP和法規(guī)指南”項下下載的PPT模版�����,其他審查類別匯報PPT無特殊要求。除初始審查�、修正案審查項目外,提交會議審查的其他類型跟蹤審查����,若主審委員預(yù)審意見為“同意/批準(zhǔn)”,則由倫理秘書代為匯報���,但是預(yù)審意見一般在會議前一天才能確定��,因此完善答辯人信息時仍需填寫預(yù)備答辯人員的信息���。
“制度與SOP”——“公告、制度SOP和法規(guī)指南”項下下載的PPT模版�����,其他審查類別匯報PPT無特殊要求。除初始審查�、修正案審查項目外,提交會議審查的其他類型跟蹤審查����,若主審委員預(yù)審意見為“同意/批準(zhǔn)”,則由倫理秘書代為匯報���,但是預(yù)審意見一般在會議前一天才能確定��,因此完善答辯人信息時仍需填寫預(yù)備答辯人員的信息���。
21.自2025年2月起,本中心以電子版的形式傳達倫理審查決定�,大家可在倫理系統(tǒng)“項目管理”——“項目信息總覽”——“狀態(tài)”——“意見”處下載![]()
![]() 主任委員/被授權(quán)人簽字并加蓋本中心倫理委員會公章的PDF版?zhèn)惱韺彶闆Q定,會議簽到表請于“制度與SOP”——“公告�、制度SOP和法規(guī)指南”項下下載。
主任委員/被授權(quán)人簽字并加蓋本中心倫理委員會公章的PDF版?zhèn)惱韺彶闆Q定,會議簽到表請于“制度與SOP”——“公告�、制度SOP和法規(guī)指南”項下下載。
22.若下載的倫理審查決定缺少主任委員/被授權(quán)人簽字及公章�,提示該審查決定處于等待主任委員/被授權(quán)人確定的階段,請大家隔日再看���;若涉及初始審查或修正案審查的項目���,請先確認(rèn)已上傳相應(yīng)審查的倫理審查費打款憑證��,否則將無法下載完整的倫理審查決定��。
23.本院目前僅對初始審查(5000+300元)��、初始審查后重審(會議審查���,4000+240元)、修正審查(會議審查4000+240元�,快速審查1000+60元)收取倫理審查費用,其余審查類別均不收費�,請大家收到《倫理審查費通知單》后再按《倫理審查費通知單》上的要求備注倫理受理編號后打款,以免產(chǎn)生后續(xù)不必要的退款或影響財務(wù)發(fā)票的準(zhǔn)確開具�。
24.倫理系統(tǒng)使用指南
權(quán)限開通后,在下列界面點擊“項目信息”�����,在“項目列表信息”下點擊“新增”進入新增項目的項目信息填寫界面�����,請按表格要求完善項目信息�����,以利于倫理委員會對項目的管理�。
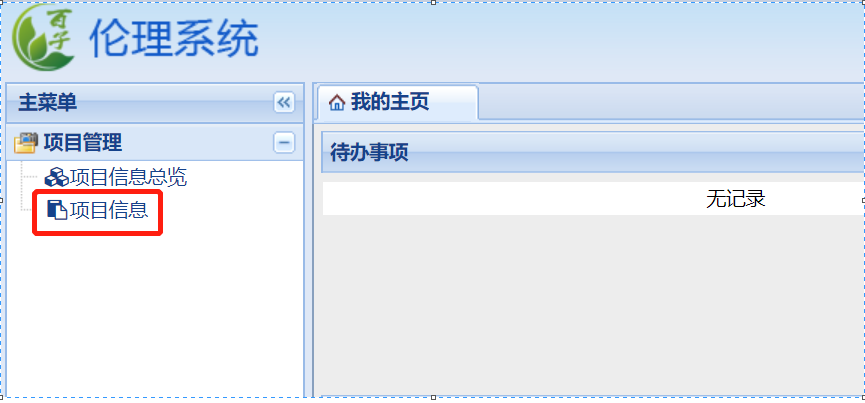
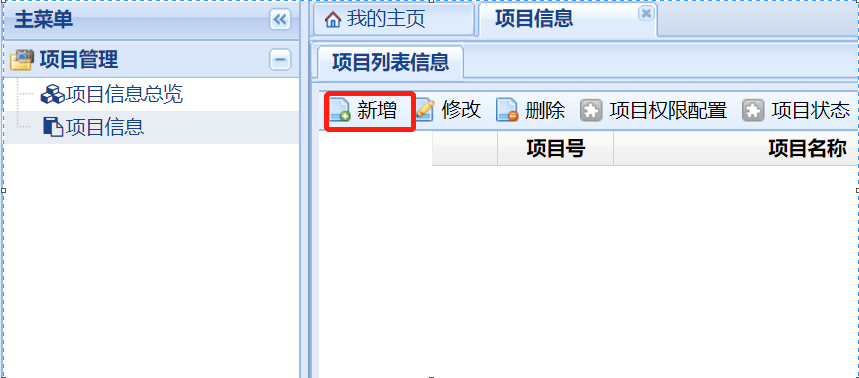
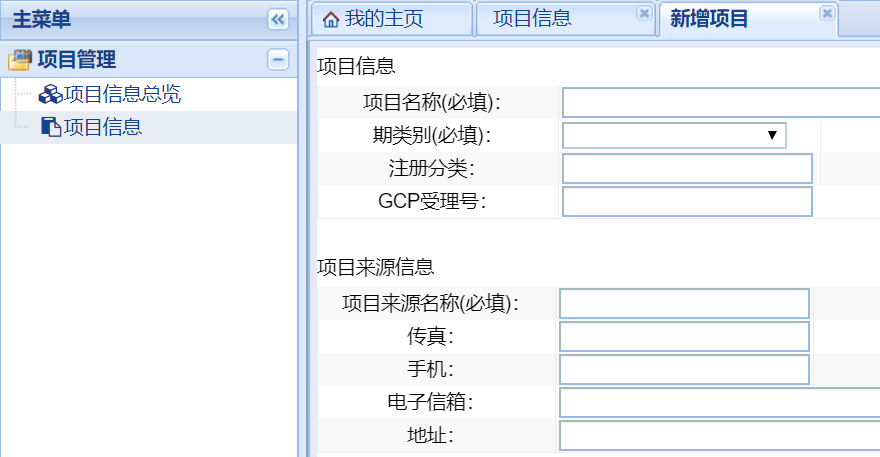
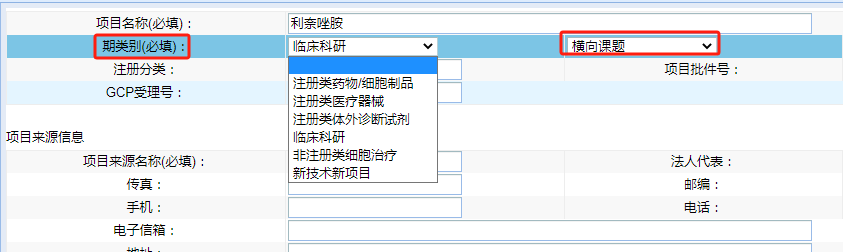
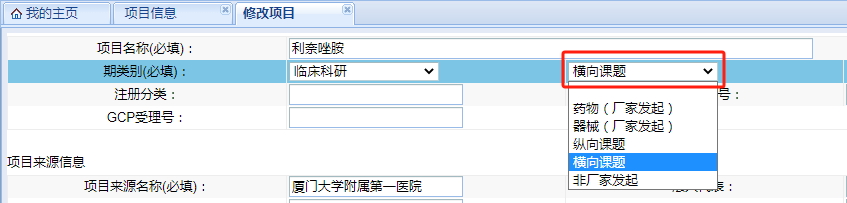
“期類別(必填)”請根據(jù)臨床試驗/臨床研究的具體情況進行選擇,類別勾選錯誤將導(dǎo)致系統(tǒng)調(diào)用的“遞交文件清單”錯誤����,后續(xù)需要重新勾選、上傳文件����。若不確定可撥打電話0592-2139562、2137569進行確認(rèn)����。
依次點擊下圖中的“申請報告”、“申請/報告”����、“新增”,并在下拉框中選擇需遞交資料的項目名稱�。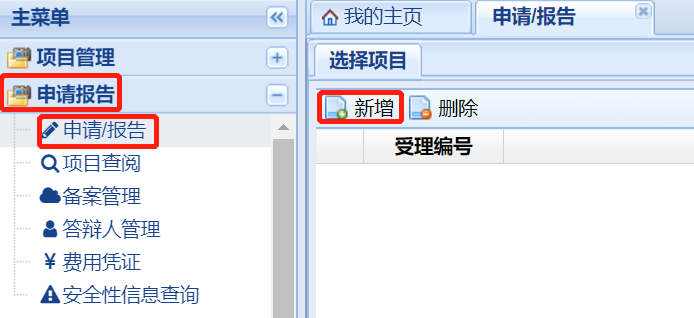
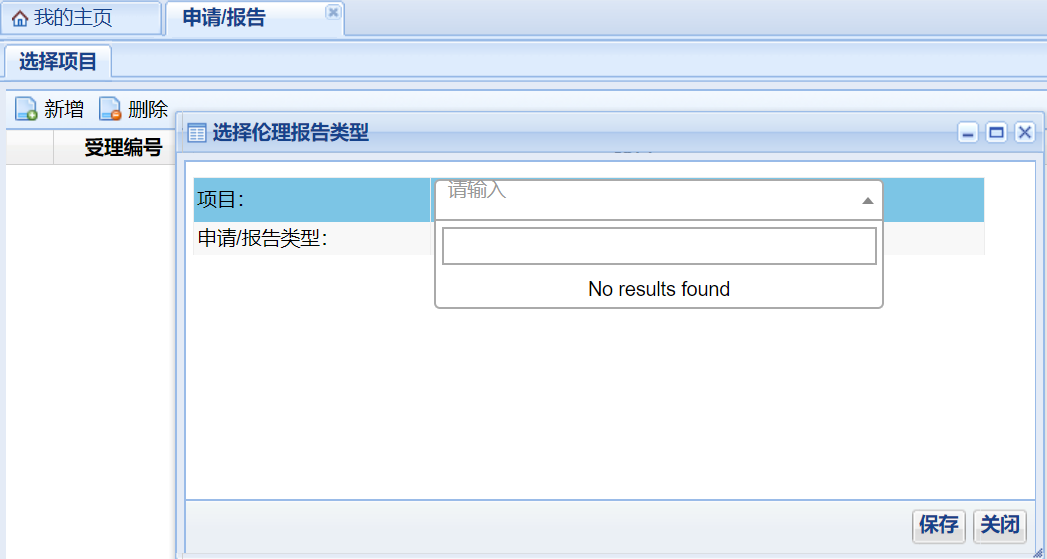
在“申請/報告類型”下拉菜單中選擇所需遞交資料的類型,選擇完畢后點擊“保存”���。
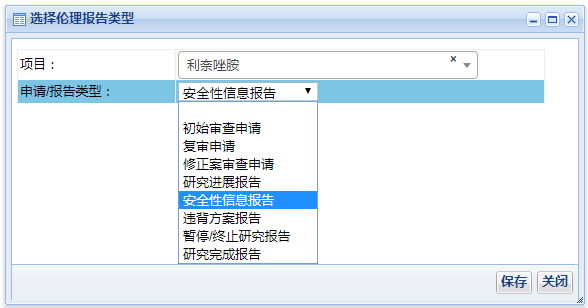
上述操作點擊“保存”后系統(tǒng)將出現(xiàn)相應(yīng)的審查申請表及送審文件清單�����,如:若選擇的是“初始審查申請”則系統(tǒng)會跳出“初始審查申請表”并出現(xiàn)“送審文件清單”��。
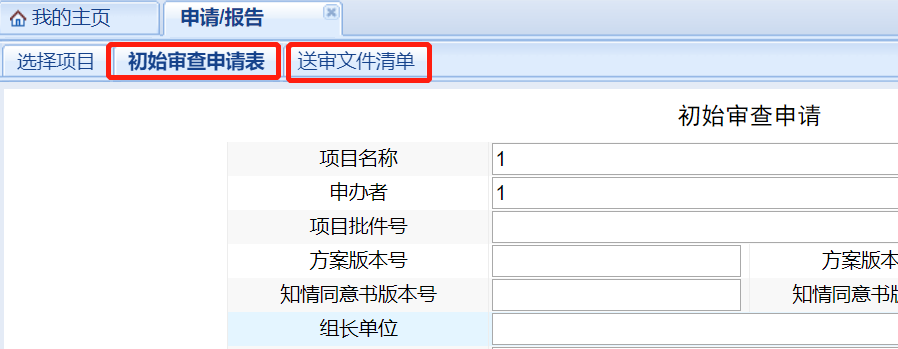
按照實際情況填寫審查申請表�����,填寫完整后依次點擊“保存”��、“下一步”�,進入審查資料的上傳階段。
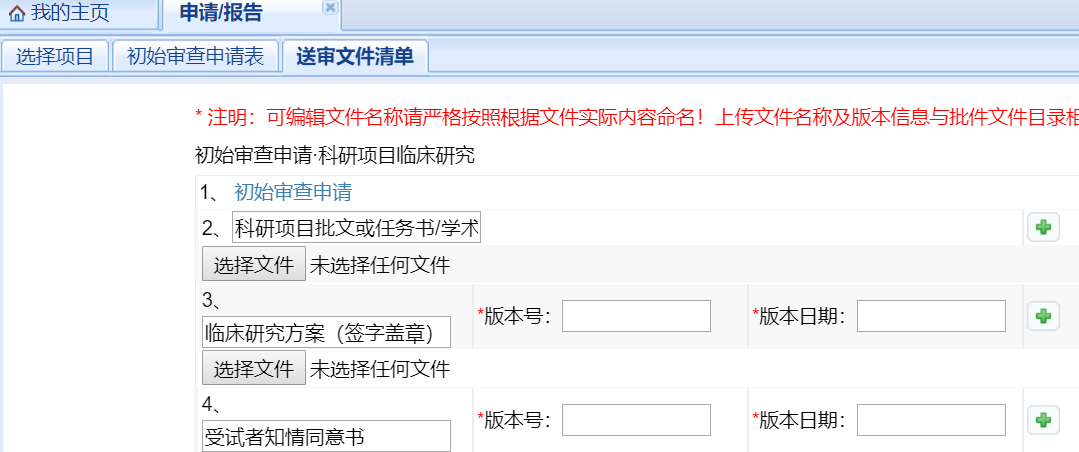
請注意需要填寫藍色字體的審查申請�,否則將無法提交項目申請,并根據(jù)送審文件清單所列的需要提交的資料類型進行提交��,若相應(yīng)項下無相關(guān)資料需要提交���,則跳過��,請不要在本是上傳方案處改名上傳知情同意書���,在知情同意書處改名上傳方案或其他資料。點擊綠色的“+”可以追加該項下的資料,系統(tǒng)僅支持上傳pdf/jpg/jpeg/png/gif格式的文件����。如果“送審文件清單”項下的有關(guān)模板無法下載或者下來文件亂碼可以在“制度與SOP”項下下載����。
資料上傳完畢后,依次點擊“保存”���、“提交”�����,系統(tǒng)會將相應(yīng)審查申請表及資料發(fā)送至倫理秘書進行形式審查����。如果要修改��,需在提交前雙擊要修改的選項��,進行修改后保存�����。提交之后需要修改,可自行撤回倫理秘書尚未處理的審查申請�,秘書開始處理的需聯(lián)系倫理秘書撤回。
如果未通過倫理秘書的形式審查后���,申請者將會收到“補充/修改/撤銷材料”通知(顯示在我的主頁——待辦事項里)�����,此時申請者可點擊“查看”�����,按照要求�����,準(zhǔn)備補充修改的材料�����。
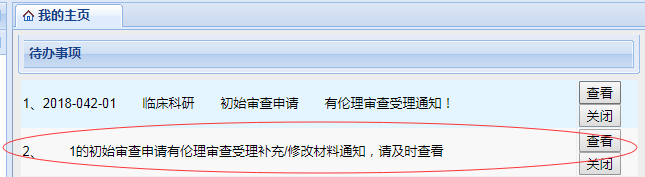
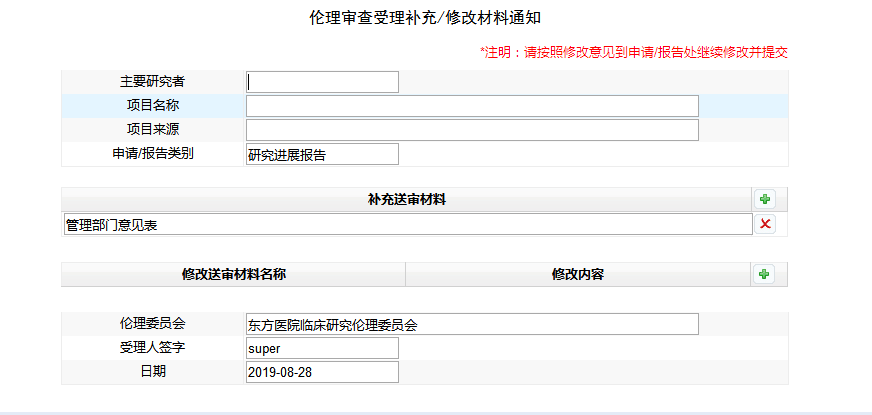
補充修改相關(guān)材料時���,點擊申請報告---選擇項目---點擊需要補充材料的項目名稱---重新填寫或上傳相關(guān)材料進行保存提交。
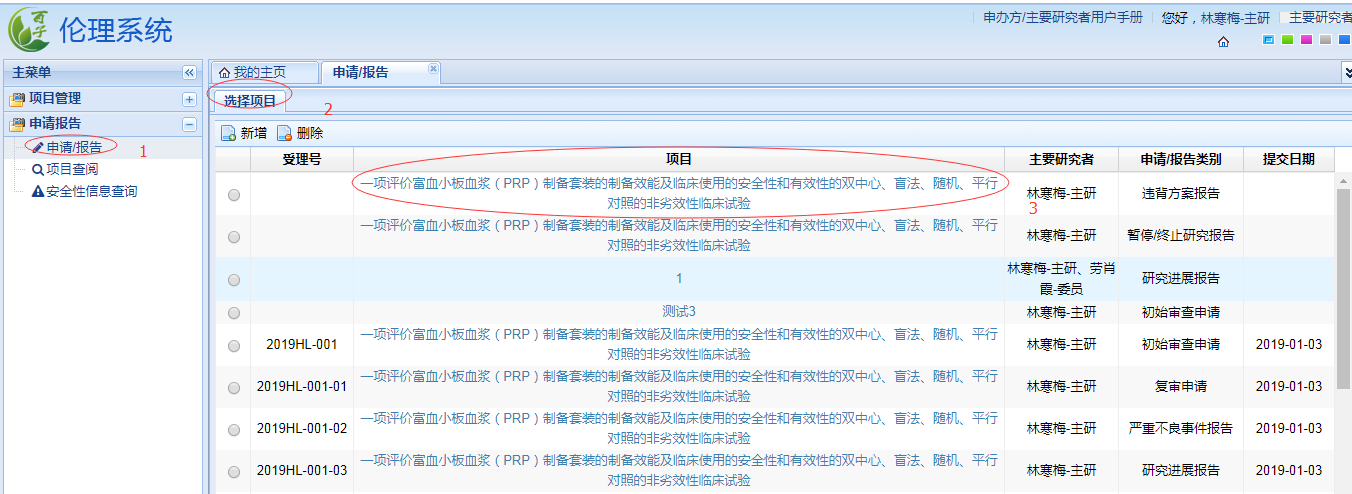
提交資料若通過倫理秘書的形式審查并被成功受理會在“我的主頁”——“待辦事項”顯示受理通知�����。申請人在項目管理——申請報告中下載、打印相應(yīng)的倫理審查申請表(下載的倫理審查申請表會自動加上送審文件清單中的文件信息)�����,待主要研究者簽名�����、簽日期(日期簽簽名當(dāng)日的)后將文件掃描上傳至倫理審查系統(tǒng)�,秘書核對后確認(rèn)提交即進入審查流程�����。
僅廠家發(fā)起的初始審查項目需遞交整套送審文件的紙質(zhì)版存檔�,其他審查類別無需遞交紙質(zhì)版。遞交初始審查紙質(zhì)版資料時�,請同時遞交一個已存入從倫理審查系統(tǒng)下載的整套初始審查送審文件的移動硬盤作為后續(xù)保存項目電子版文件的媒介至醫(yī)學(xué)倫理辦公室保存,后續(xù)需定期(一般參照定期跟蹤審查頻率)將系統(tǒng)產(chǎn)生的項目電子版文件保存至移動硬盤���。首次遞交移動硬盤時����,移動硬盤請以倫理項目號及主要研究者科室、姓名進行命名�����,硬盤外部也需做好相應(yīng)標(biāo)識�����。
9月11日起系統(tǒng)受理的項目���,除初始審查項目外無需再遞交紙質(zhì)版資料(過渡期可能某些項目仍需遞交紙質(zhì)版����,請以項目責(zé)任秘書的要求為準(zhǔn))��,9月11日之前系統(tǒng)受理的項目仍按之前的流程遞交紙質(zhì)版材料���。
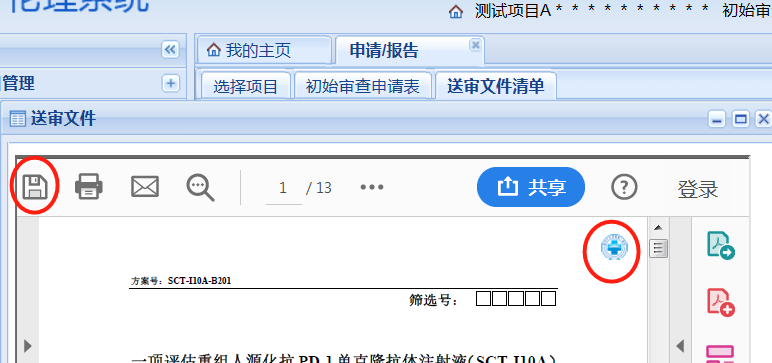
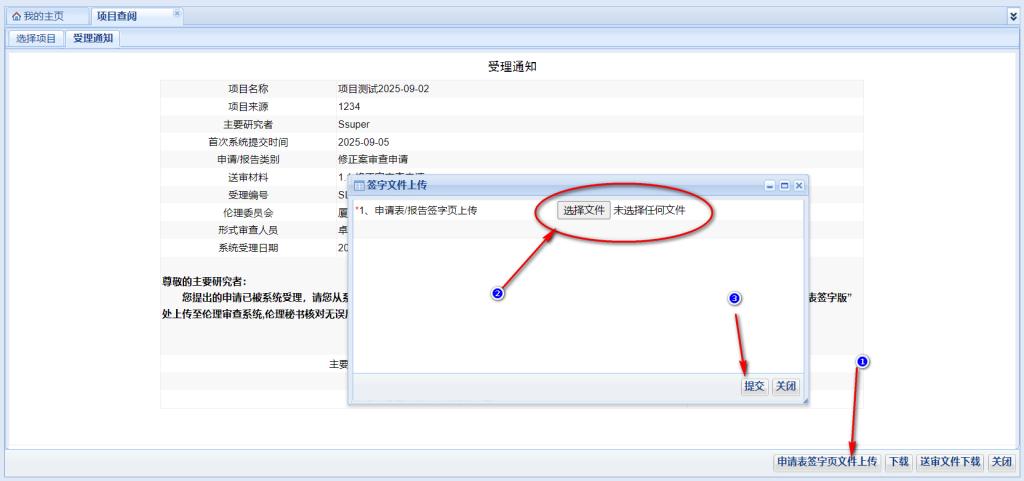
在受理通知頁面的右下角有“申請表簽字頁文件上傳”按鈕���,按照如下的操作即可完成簽字頁上傳。
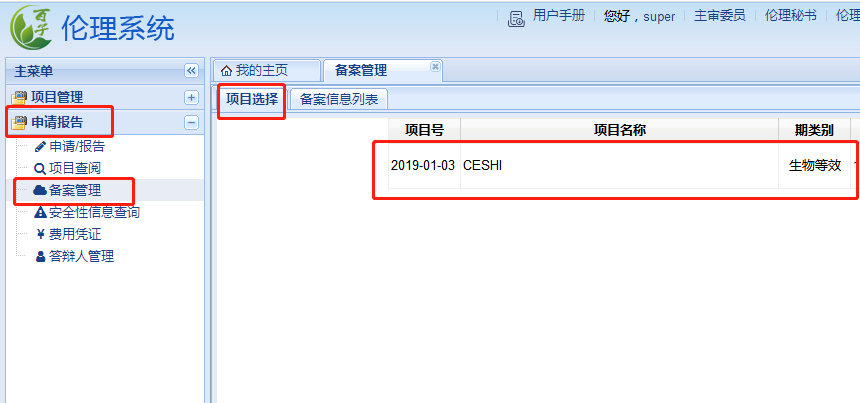
備案資料的上傳
點擊“申請/報告”——“備案管理”——“項目選擇”����,點擊相應(yīng)項目后點擊新增備案��。注意上一次的備案資料已上傳但未提交���,則下一次備案資料不能提交。
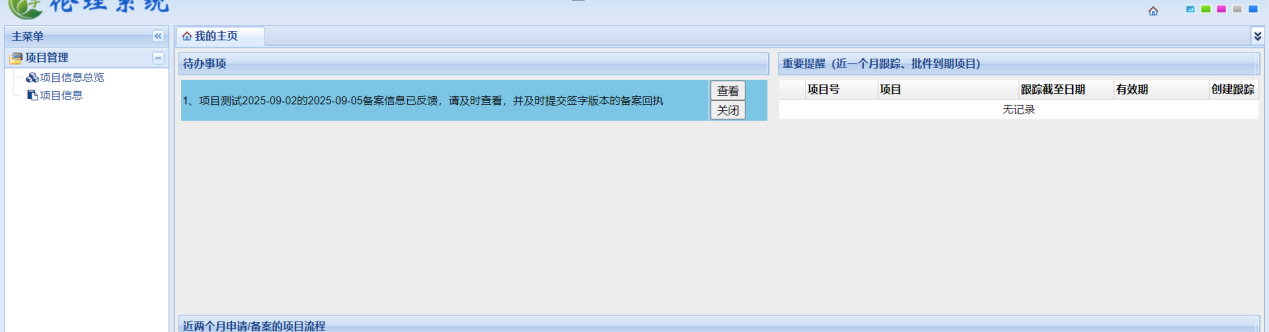
倫理秘書系統(tǒng)受理后����,申請方收到需要遞交備案回執(zhí)簽字版本的待辦,下載遞交文件回執(zhí)�,并待主要研究者簽字���、簽日期后將遞交文件回執(zhí)掃描后上傳����,倫理秘書確認(rèn)后即完成資料備案流程����。
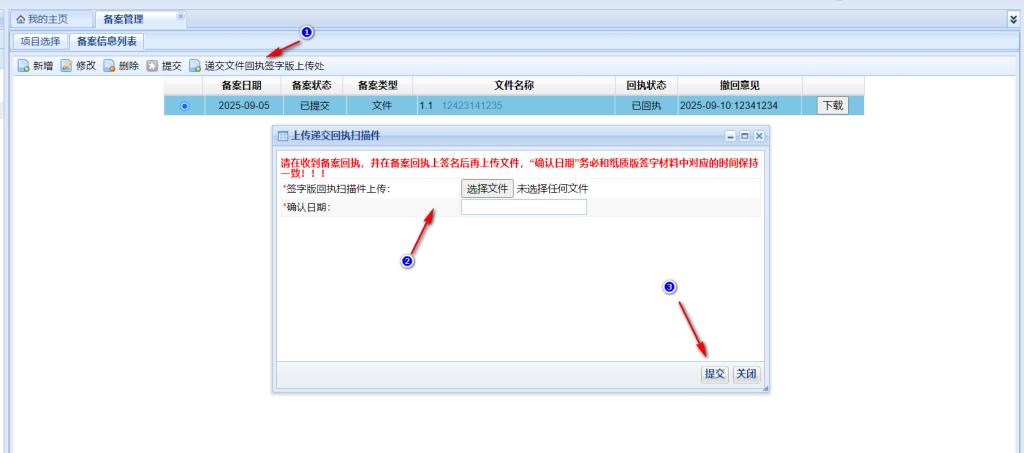
倫理審查費用
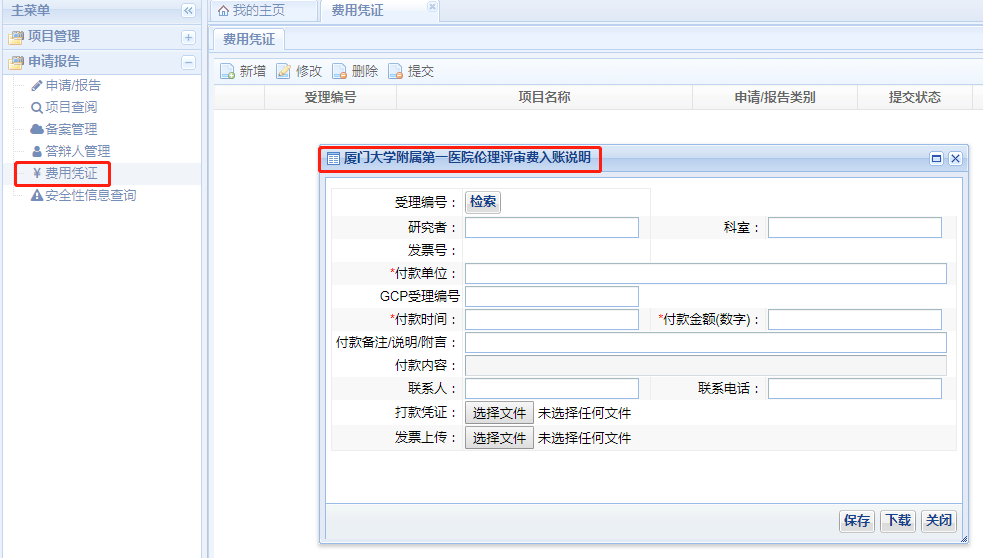
需要收取倫理審查費用的項目倫理秘書在系統(tǒng)受理后會填寫《倫理審查費通知單》并由系統(tǒng)發(fā)送,請按照《倫理審查費通知單》上的要求匯款�,應(yīng)特別注意匯款時按倫理要求備注項目資料的受理號,財務(wù)打款后請及時在下圖所示界面中填寫倫理審評費入賬說明�����,并上傳匯款憑證,以便順利的領(lǐng)取發(fā)票�。若發(fā)現(xiàn)需要收費的初始審查及初始審查修改后重審的項目、修正案審查項目秘書未發(fā)送《倫理審查費通知單》請聯(lián)系秘書補發(fā)送��,否則將影響完整倫理審查決定的下載�����。
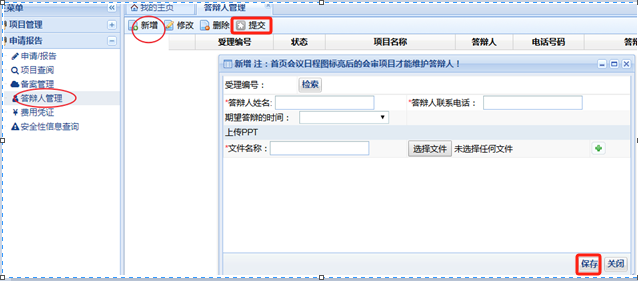
會議審查答辯人管理
需要倫理委員會會議審查的項目�����,在倫理審查會議開會前���,需要將答辯人信息及答辯用PPT上傳至倫理系統(tǒng)平臺����。
倫理上會前����,系統(tǒng)會給各個項目主要研究者及系統(tǒng)中有授權(quán)的人員(一般為CRA/CRC)發(fā)送請及時完善答辯人管理的手機短信,請及時到系統(tǒng)中維護答辯人信息��,若答辯的PPT未確定請先填寫答辯人信息���,逾期可能會取消本次上會資格��!首頁會議日程圖標(biāo)點亮后的會審項目才能進行答辯人維護�����,沒有點亮���,就不能維護答辯人�。
完善相應(yīng)信息填寫及上傳答辯PPT后����,請記得點擊“提交”����,否則倫理秘書端將無法下載上傳的答辯PPT。
本指南未涉及的相應(yīng)內(nèi)容��,可通過倫理系統(tǒng)下載《用戶手冊》進行學(xué)習(xí)��。
